Riesgo genético de glioma
El presente estudio proporciona un marco más integrado para la investigación etiológica del glioma de bajo grado que podría ayudar a reenfocar los esfuerzos para impedir la ocurrencia de esta condición (es decir, prevención secundaria), particularmente en poblaciones de alto riesgo.
Los gliomas de bajo grado en adultos son tumores cerebrales primarios de infiltración difusa que se definen por la presencia de variantes somáticas en los genes que codifican la isocitrato deshidrogenasa: IDH1 (ubicado en el cromosoma 2) e IDH2 (ubicado en el cromosoma 15). Estos genes son casi idénticos en estructura. Las mutaciones específicas en IDH interrumpen el metabolismo celular, inducen la metilación del ADN y cambian la estructura de la cromatina. Los gliomas con IDH mutado incluyen astrocitoma (grados 2 a 4) y oligodendroglioma (grados 2 y 3); este último se define por la presencia adicional de co-deleción cromosómica en 1p y 19q. Los gliomas de bajo grado representan el 25% de las 17.000 formas infiltrantes que se diagnostican anualmente en los Estados Unidos. A pesar de la investigación sobre su biología molecular, estos tumores inevitablemente recurren y finalmente resultan fatales. La escasez de mutaciones impulsoras limita los enfoques para la oncología de precisión y ha generado un interés renovado en el potencial de los factores de riesgo genéticos hereditarios sobre los procesos moleculares que subyacen a la formación de gliomas de bajo grado que pueden revelar enfermedades preventivas o dianas terapéuticas.
Los estudios de asociación de todo el genoma han identificado cientos de polimorfismos genéticos asociados con la predisposición al cáncer, incluidos 19 loci relacionados con el riesgo de glioma de bajo grado. Uno de esos polimorfismos que se encuentra en el cromosoma 8q24 se destaca entre la panoplia de éxitos de los estudios de asociación del genoma del cáncer debido a su tamaño de efecto excepcionalmente grande. Descrito por primera vez en 2012, el alelo G de rs55705857 existe con una frecuencia en aproximadamente el 7% de poblaciones de ascendencia europea, está relacionado con un peligro de glioma de bajo grado con IDH mutado que es seis veces mayor que en personas sin el alelo G, y no está asociado con el riesgo de glioblastoma IDH de tipo salvaje. Al igual que muchas otras variantes vinculadas a rasgos identificadas, rs55705857 no altera la región codificante de proteínas de ningún gen, y no se ha establecido cómo confiere riesgo de cáncer. Esta interrogante fue abordada en un reciente estudio por Connor Yanchus y colaboradores (Science 2022; 378: 68-78) quienes encontraron que rs55705857 confiere directamente un riesgo de glioma de bajo grado a través de una regulación positiva aberrante y de larga distancia de MYC en tejidos derivados de la cresta neural, incluidas las células de que surgen los gliomas de bajo grado.
Se realizó un análisis del locus 8q24 (rs55705857 y secuencia de ADN flanqueante) a partir de muestras de ADN obtenidas de pacientes con gliomas de bajo grado y de controles, indicando que solo rs55705857 puede explicar la relación observada entre el glioma de bajo grado y los polimorfismos en el cromosoma 8q24. Hasta ahora, seguía siendo posible que otra variante genética en el locus 8q24 fuera el verdadero impulsor de la asociación. Estudios bioinformáticos adicionales revelaron una mayor accesibilidad a la cromatina (también llamada "cromatina abierta") en rs55705857 de tejidos derivados de la cresta neural, en particular linajes neuronales y de melanocitos. El análisis de los datos relacionados con el glioma también evidenció una cromatina abierta en el glioma de bajo grado mutante IDH, pero no en IDH, hallazgo que brinda una explicación biológica plausible de la especificidad de la asociación de la variante con el glioma de bajo grado.
Los autores generaron un modelo de ratón para detectar actividad potenciadora. Estos experimentos concluyeron que tanto el alelo de riesgo rs55705857 como el alelo protector tienen actividad potenciadora en el prosencéfalo y tubo neural, pero que el alelo de riesgo es más fuerte en estas estructuras, así como actividad adicional en el mesencéfalo. La tinción celular develó la especificidad tisular de este efecto, con rs55705857 funcionando como un potenciador activo en las células embrionarias que dan lugar a células madre neurales y células precursoras de oligodendrocitos, las células hipotéticas de origen del astrocitoma y el oligodendroglioma, respectivamente.
Habiendo demostrado lo anterior, se pasó a demostrar que el alelo de riesgo rs55705857-G interrumpe la unión de dos proteínas que normalmente reprimen la transcripción de MYC: los factores de transcripción OCT2 y OCT4. Los ensayos de conformación cromosómica establecieron una interacción física entre el promotor del oncogén MYC y el locus rs55705857, y el alelo de riesgo tuvo una actividad potenciadora más fuerte que el alelo protector. En conjunto, los autores propusieron que el alelo de riesgo rs55705857-G disminuye la unión represiva de OCT y, por lo tanto, en el contexto de las elevaciones inducidas por la mutación IDH en la accesibilidad de la cromatina, aumenta la activación MYC provocando una interacción potenciador-promotor (figura 1). En un modelo de ratón modificado genéticamente de astrocitoma IDH mutado, el cambio del locus ortólogo rs55705857 al alelo de riesgo rs55705857-G aumentaba la tasa de formación de gliomas de bajo grado del 30% al 75%, acelerando el desarrollo tumoral de 472 a 172 días. Estos datos indican que las mutaciones de IDH pueden afectar la tumorigénesis al facilitar la activación de MYC.
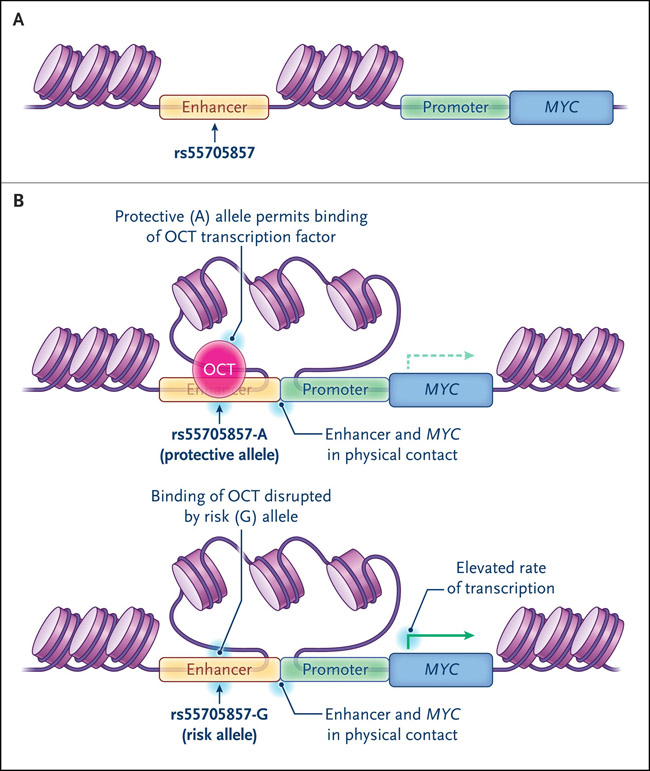
Figura 1: expresión del oncogén MYC en glioma de bajo grado asociado con estado IDH y genotipo rs55705857.
El nexo entre rs55705857-G y el riesgo de glioma de bajo grado se ha reconocido durante una década, pero no se ha traducido en modelos útiles de predicción del riesgo debido a las limitaciones inherentes a la detección de una enfermedad rara (es decir, altas tasas de falsos positivos). Un reciente estudio de asociación del genoma respecto a la morfología del cerebro vinculó la variante rs55705857 con diferencias en el grosor cortical, el área de superficie cortical y la microestructura de la materia blanca, hallazgos que indican que la variante puede influir en el desarrollo embrionario temprano. Por lo tanto, es posible que las características neurales que predisponen al inicio del glioma de bajo grado se establezcan en el útero. La exposición a la radiación ionizante sigue siendo el único factor de riesgo establecido y modificable para el glioma de bajo grado, lo que limita las oportunidades de prevención primaria. Recientemente se han observado mutaciones oncogénicas de IDH1 en muestras de tejido cerebral de personas sin enfermedad neurológica.
Fuente bibliográfica
Understanding the Genetic Risk of IDH-Mutant Glioma
T. T. Batchelor and K. M. Walsh
Department of Neurology, Brigham and Women’s Hospital, Boston (T.T.B.); and the Department of Neurosurgery and Preston Robert Tisch Brain Tumor Center, Duke University Medical Center, Durham, NC (K.M.W.).
N Engl J Med 2023; 388:1332-1334