Regulación epigenética del asma
La interleuquina 9 (IL-9) es una citoquina pleiotrópica asociada con la inflamación alérgica y es una diana terapéutica en pacientes con asma. Su expresión y la de su receptor son mayores en los pulmones de las personas con asma que en los de las personas sanas. En los modelos murinos de enfermedad alérgica de las vías respiratorias, la IL-9 promueve la hiperreactividad de las vías respiratorias, la remodelación y la inflamación, con una característica clave que es el reclutamiento y activación de mastocitos. Se piensa que un subconjunto de células T CD4, denominadas células Th9, es la fuente dominante de IL-9 en asmáticos, y su número aumenta en alérgicos. Las Th9 son suficientes para promover la enfermedad alérgica de las vías respiratorias en modelos de ratones, y el bloqueo de su diferenciación reduce la gravedad patológica en estos modelos, lo cual representa un punto clave para evaluar nuevas alternativas terapéuticas en humanos.
Células productoras de IL-9
En un reciente estudio, Xiao y sus colegas demostraron la importancia del escenario epigenético que rodea a Il9 (el gen que codifica la IL-9 en ratón) sobre la regulación de la diferenciación de las células Th9 (DOI: 10.1084/jem.20170928). Específicamente, encontraron que elementos super potenciadores (super enhancer) río abajo de Il9 son fundamentales para impulsar la producción robusta de IL-9 por parte de las células T CD4 y promover la enfermedad alérgica de las vías respiratorias. Los super enhancer son áreas del genoma que (mediante cambios secundarios y terciarios en la estructura de la cromatina) entran en contacto con promotores de genes y son áreas a las que se unen complejos transcripcionales. Al facilitar la yuxtaposición de complejos transcripcionales con un promotor de genes, pueden mejorar la expresión de ese gen.
A menudo se identifican, como en el estudio de Xiao y sus colegas, por la agrupación de una proteína histónica específica (H3) que es acetilada en la lisina 27 (H3K27Ac), una marca de actividad transcripcional. (Las histonas forman estructuras en forma de carrete alrededor de las cuales se enrolla el ADN y también regulan la estructura de la cromatina y la expresión génica. Histonas acetiladas pueden estar unidas a una familia de proteínas denominada bromodominio y dominio extraterminal (familia BET) que modifican la expresión génica.
La producción de IL-9 por parte de las células T CD4 es impulsada por su exposición a combinaciones específicas de citoquinas. Los investigadores encontraron que la estimulación de una vía de señalización diferente de las células T CD4 (que involucra al receptor OX40) in vitro, aumenta este proceso al incrementar drásticamente el número de células T CD4 productoras de IL-9 a través de una serie de eventos que resultan en la acetilación de histonas (específicamente, H3K27) tanto en Il9 como en una región superenhancer río abajo del sitio de inicio de la transcripción de Il9.
Esto a su vez resultó en el reclutamiento de BRD4, una proteína BET, y la formación de un bucle de cromatina entre el superenhancer de Il9 y su promotor (Figura 1), un proceso que es esencial para la máxima diferenciación de las células Th9. Resaltando el potencial terapéutico de esta nueva capa de regulación de las células Th9, los autores también encontraron que el uso de un inhibidor BET, o el silenciamiento específico de Brd4 en un modelo de ratón de enfermedad alérgica de las vías respiratorias, resultó en una reducción de los niveles de IL-9, una disminución de la inflamación pulmonar y una reducción de la eosinofilia de las vías respiratorias.
Sin embargo, se debe tener precaución al interpretar este estudio como apoyo del potencial terapéutico de dirigirse específicamente a la IL-9 en pacientes con asma. Xiao y colaboradores utilizaron el inhibidor BET (llamado JQ1) profilácticamente -antes de la aparición de la inflamación pulmonar- en el modelo de ratón, lo que no es factible en humanos. Además, un ensayo clínico que evaluó el bloqueo de OX40L que incluyó a personas con asma leve mostró que la focalización en esta vía no tuvo efecto sobre el volumen espiratorio forzado inicial en 1 segundo (VEF1), ni sobre la respuesta alérgica en fase temprana o tardía, o el número de exacerbaciones, aunque sí redujo la eosinofilia en esputo y el nivel total de IgE. Además, el uso de un anticuerpo monoclonal anti IL-9 en pacientes con asma moderada a severa no alteró el VEF1, las tasas de exacerbación o la eosinofilia sanguínea. Por lo tanto, las estrategias diseñadas para afinar la producción de citocinas, por medio de marcas epigenéticas, pueden ofrecer una nueva opción terapéutica.
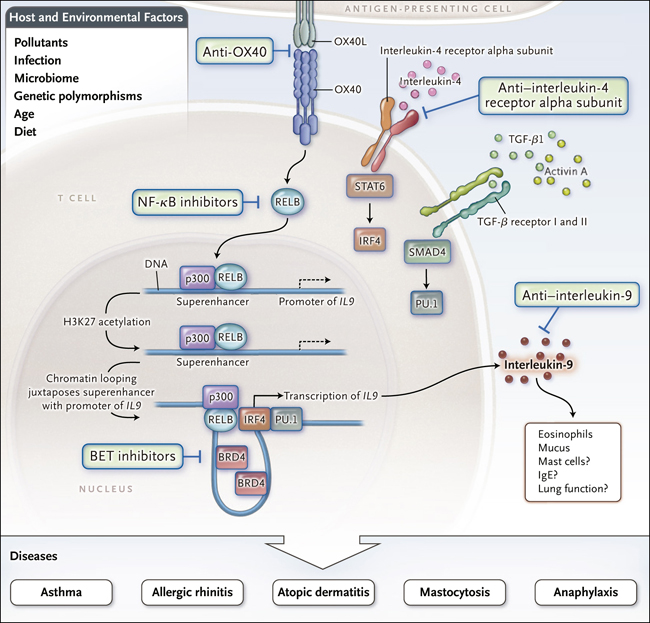
Figura 1. Control en la inflamación alérgica y células T secretoras de interleucina 9.
Xiao y colegas descubrieron recientemente que la producción de IL-9 por células Th9 es potenciada por OX40, que activa RELB en conjunto con la histona acetiltransferasa p300, resultando en acetilación de la proteína histona en la lisina 27 (H3K27) y en el reclutamiento de la proteína bromodominio y extraterminal (BET) BRD4. Se forma un bucle de cromatina entre el promotor de la IL9 y la región superenhancer, maximizando así la diferenciación de las células Th9 y facilitando potencialmente enfermedades en las que la IL-9 desempeña un rol patogénico. La interrupción selectiva de este proceso, por ejemplo, con inhibidores BET puede representar una nueva estrategia terapéutica para las enfermedades mediadas por la IL-9. Las células Th9 secretoras de IL-9 (un subconjunto de células T CD4) se desarrollan en respuesta a la activación del transductor de señal y activador de la transcripción 6 (STAT6) que es dependiente de IL-4. Este proceso impulsa la translocación nuclear de un factor transcripcional denominado factor de regulación del interferón 4 (IRF4), combinado con la activación dependiente del factor de crecimiento transformante β (TGF-β) de SMAD4, que promueve el factor de transcripción PU.1 (codificado por SPI1). IRF4 y PU.1 se unen al promotor de IL9. Múltiples elementos ambientales y del huésped influyen en la regulación epigenética de la producción de citoquinas durante la inflamación alérgica. Estos factores afectan a los superenhancer que facilitan la expresión robusta de citoquinas.
La regulación epigenética de la producción de citoquinas por parte de las proteínas BET en el asma probablemente tiene efectos que son independientes de la diferenciación de las células Th9 o de la producción de IL-9. Las proteínas BET están muy implicadas en la producción de interleuquinas proinflamatorias por parte de los macrófagos, y se ha demostrado que los inhibidores BET limitan la inflamación y mortalidad en modelos de sepsis y perturban la diferenciación de células T CD4 secretoras de IL-17, que también se cree que participan en la patogénesis en algunos pacientes con asma. Por lo tanto, dirigir la actividad de la proteína BET a personas con asma que tienen inflamación severa o heterogénea puede ser más efectivo que los tratamientos existentes, que están diseñados para abordar un aspecto de la patología del asma (por ejemplo, IgE).
También cabe destacar que aunque el presente estudio destaca el papel potencial de la regulación epigenética de la IL-9 en pacientes con asma alérgica, esta citoquina se ha implicado en otras enfermedades en las que se produce la acumulación o activación de mastocitos (Figura 1). Los autores no evaluaron el número de este tipo celular ni su función. Tampoco analizaron los niveles de IgE, y los modelos de asma alérgica en ratones no generan el número sustancial de mastocitos ni la actividad que a menudo se presentan en pacientes con alergia. Por ende, se requiere trabajo adicional para determinar si la inhibición de la BET por la JQ1 sería efectiva en las enfermedades dependientes de mastocitos, como la rinitis alérgica o la dermatitis atópica.
En resumen, Xiao y sus colegas describen una nueva forma de regulación epigenética para la producción de citoquinas asociadas con el asma y, por lo tanto, proporcionan otro punto para tratar la inmunidad desrregulada en pacientes asmáticos o alérgicos. Debido a que el tejido pulmonar asmático se asocia con una mayor expresión de histonas acetilasas y una menor expresión de histonas deacetilasas, es tentador especular que las células T CD4 en pacientes con asma podrían mostrar un aumento de la actividad superenhancer en el locus de la IL9 y otros loci - como consecuencia de influencias ambientales o genéticas o una combinación de ambas - y que dicha actividad pudiera explicar potencialmente la predisposición para el desarrollo de la enfermedad atópica en algunas personas, pero no en todas.
Fuente bibliográfica
Epigenetic Control of Interleukin-9 in Asthma
Clare M. Lloyd, Ph.D., and James A. Harker, Ph.D.
Section of Inflammation, Repair, and Development, National Heart and Lung Institute, Imperial College London.
DOI: 10.1056/NEJMcibr1803610