Eliminar al patógeno y salvar la placenta
Mediante un modelo de ratón para infección placentaria un reciente estudio mostró que las células asesinas naturales deciduales enfrentan a Listeria monocytogenes a través de un sigiloso ataque que involucra a los nanotubos de actina.
El embarazo humano saludable requiere un cuidadoso acto de equilibrio: el sistema inmunológico materno no debe rechazar al feto, que es extraño, pero debe estar listo para atacar patógenos como bacterias y virus. Las células asesinas naturales deciduales (NK, por sus siglas en inglés) ayudan a mantener tal equilibrio. Estas células invaden el lado materno de la placenta (es decir, la decidua). Sin embargo, su clásico modo lítico, que libera gránulos citotóxicos contenedores de péptidos que lisan la membrana, dañaría al huésped. Ângela C. Crespo y colaboradores acaban de describir un mecanismo nuevo y más preciso mediante el cual las células NK deciduales atacan a los patógenos sin dañar la placenta y feto.
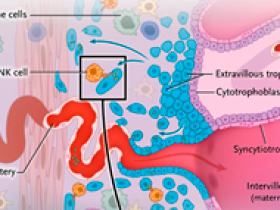
El acto de equilibrio de mantener la tolerancia inmunitaria del feto y la inmunidad protectora se produce en la interfaz materno-fetal de la placenta. Esta última se forma cuando los citotrofoblastos derivados de embriones se fusionan para crear sincitiotrofoblastos multinucleados, que median el intercambio materno-fetal de nutrientes y gases. Los citotrofoblastos también forman las vellosidades que anclan el embrión a la pared uterina. Además, ocupan el espacio decidual (y por tanto son trofoblastos extravellosos, figura 1), donde remodelan las arterias espirales maternas, aumentando el riego sanguíneo al feto. Para evadir el reconocimiento como "extraño" por las células inmunes de la madre, los trofoblastos extravellosos expresan HLA tolerogénicos: HLA-G, HLA-E y HLA-C. La expresión de HLA-G por los trofoblastos extravellosos es fundamental para "educar" a las células NK deciduales con el fin de promover la tolerancia; esto se logra mediante proyecciones filamentosas que sirven como sinapsis entre los trofoblastos y las células NK deciduales. Sin embargo, los parásitos, los virus y la bacteria Listeria monocytogenes pueden subvertir este mecanismo para infectar la placenta y el feto. La tolerancia de los trofoblastos extravellosos por las células NK deciduales permite la infección del feto por L. monocytogenes, dando como resultado la pérdida fetal. Afortunadamente, la actividad citotóxica de las células NK deciduales suele ser suficiente para eliminar a L. monocytogenes. Pero, hasta ahora, no estaba claro el mecanismo por el cual las células NK deciduales son capaces de matar a la bacteria sin dañar las células placentarias.
El equipo de Ângela Crespo concluyó que las células NK deciduales matan selectivamente a L. monocytogenes en trofoblastos extravellosos, sin acabar con estas células, inyectando la proteína granulisina en los trofoblastos a través de nanotubos (figura 1). Demostraron por primera vez que los sobrenadantes de las células NK deciduales podían matar a L. monocytogenes en cultivos de una línea celular de trofoblasto y trofoblastos extravellosos primarios. El tratamiento de las células NK deciduales con un anticuerpo antigranulisina o el bloqueo de su capacidad para secretar proteínas evitó la muerte bacteriana. Sin embargo, la destrucción de bacterias no requirió que las células NK deciduales liberaran gránulos citotóxicos. Aunque las células NK deciduales contienen tanto granulisina como perforina (que forma poros en las células diana) dentro de los gránulos, también contienen granulisina citosólica. Las células NK deciduales matan a L. monocytogenes en trofoblastos extravellosos mediante la transferencia directa de granulisina citosólica a los trofoblastos a través de nanotubos que contienen actina. El tratamiento de las células infectadas con neuraminidasa, una sialidasa que escinde los enlaces glucosídicos, limita la destrucción de bacterias, lo que sugiere que el reconocimiento de restos sialilados en trofoblastos extravellosos desencadena la formación de nanotubos.
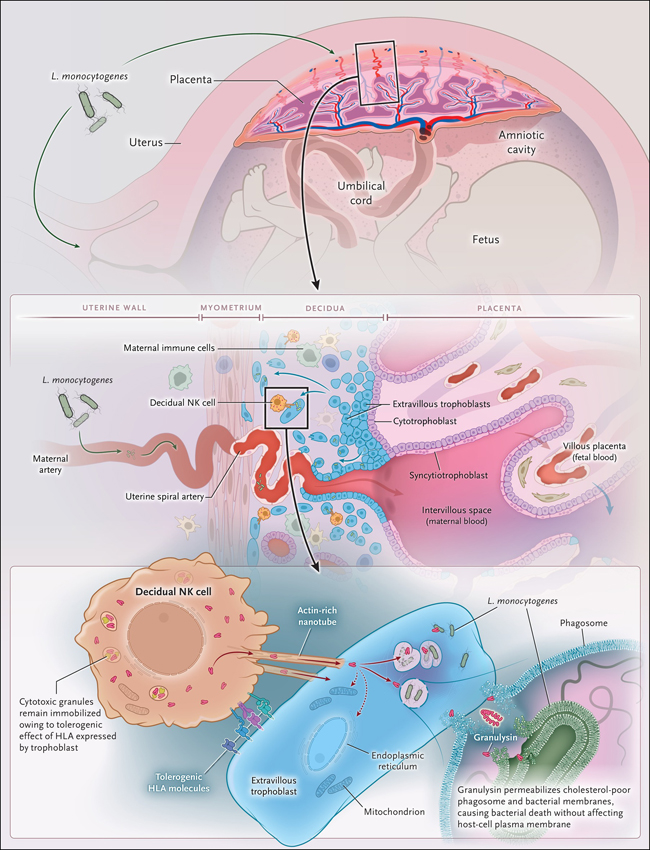
Figura 1: protección del feto por células NK deciduales
La interfase materno-fetal está formada por la decidua basal de la madre y la placenta derivada del feto. La decidua alberga una gran población de células inmunitarias maternas, incluidas las células asesinas naturales (NK) deciduales, los macrófagos, las células T y las células dendríticas. La placenta está formada por trofoblastos derivados de la capa de trofoectodermo, que rodea al embrión blastocisto y es de origen completamente fetal. El trofectodermo da lugar a citotrofoblastos, que se fusionan para crear sincitiotrofoblastos multinucleados; estas células median el intercambio de nutrientes y gases entre la circulación materna y fetal. Los citotrofoblastos también forman las vellosidades de anclaje que median la unión embrionaria-uterina; hacia el final del primer trimestre, los citotrofoblastos se extravasan hacia las arterias espirales y entran en el espacio decidual como trofoblastos extravellosos. Estos, al invadir la decidua y evadir la vigilancia inmunitaria materna, expresan HLA tolerogénicos: HLA-G, HLA-E y HLA-C. Las células NK deciduales matan selectivamente a Listeria monocytogenes dentro de los trofoblastos extravellosos sin acabar con las células mismas mediante la inyección de la proteína granulisina, a través de nanotubos ricos en actina, en los trofoblastos. La granulisina permeabiliza las membranas bacterianas pobres en colesterol y, por tanto, puede inducir la muerte celular programada microbiana, pero no afecta las membranas plasmáticas de la célula huésped.
La investigación igualmente demostró que las células NK periféricas también podían transferir granulisina a macrófagos y células dendríticas sin matar estas unidades. Por lo tanto, se puedo haber descubierto un mecanismo general por el cual las células NK matan selectivamente a los patógenos. Aunque trabajos previos habían demostrado que la granulisina es capaz de eliminar eficazmente las bacterias en presencia de perforina o granzima, la granulisina puede matar L. monocytogenes por sí sola, lo que podría considerarse un "movimiento sigiloso" que destruye las bacterias invasoras sin dar la alarma.
Los autores dieron un paso más y se preguntaron si este mecanismo ocurriría in vivo. Para abordar esta posibilidad, utilizaron ratones diseñados para expresar granulisina humana (aunque la mayoría de los mamíferos tienen GNLY, el gen que codifica la granulisina, los roedores no). Judy Lieberman y colegas habían confirmado previamente que los ratones transgénicos con GNLY eliminaban las infecciones bacterianas intracelulares (L. monocytogenes) de manera más eficiente que los controles. En el estudio actual, se determinó que los ratones transgénicos GNLY preñados eran menos susceptibles a la infección que los ratones de control. Además, el agotamiento de las células NK uterinas (las contrapartes murinas de las células NK deciduales) condujo a la reabsorción de fetos en ratones transgénicos GNLY infectados con L. monocytogenes. Sin embargo, debido a que los ratones carecen de GNLY y de varios otros genes que median la función NK en humanos, se debe tener precaución al considerar las implicaciones de estos datos para comprender la protección contra la infección bacteriana en el embarazo humano.
La granulisina pertenece a una familia de proteínas que permeabilizan eficazmente las membranas bacterianas pobres en colesterol, pero no las membranas de mamíferos ricas en colesterol (figura 1). En la acción clásica de las NK, la granulisina y otra molécula citotóxica, la granzima, se administran a las células a través de la acción de la perforina, que daña las membranas de los mamíferos. Sin embargo, la granulisina en sí misma es un arma potente y de múltiples frentes: induce la microptosis (muerte celular programada microbiana) al bloquear las defensas antioxidantes microbianas y las vías biosintéticas y metabólicas necesarias para la supervivencia bacteriana. El mecanismo por el cual la granulisina escinde selectivamente las enzimas que son esenciales para la supervivencia microbiana no está claro, pero esta capacidad puede conservarse evolutivamente: la granulisina causa un daño mitocondrial considerable, probablemente porque las membranas mitocondriales se asemejan a las membranas bacterianas. La granulisina también puede atacar las membranas de otros orgánulos con bajo contenido de colesterol (p. ej., retículo endoplásmico).
Crespo y colegas han dilucidado un nuevo mecanismo por el cual las células NK deciduales protegen al feto en desarrollo de la infección sin dañar la placenta. Un trabajo adicional para delinear hasta qué punto este mecanismo está en juego en la protección de los embarazos humanos podría conducir a nuevas estrategias para tratar las infecciones durante el proceso. Debido a que las células NK periféricas y algunas células T citotóxicas parecen compartir con las células NK deciduales la capacidad de secretar granulisina, sería interesante ver si este mecanismo mediado por nanotubos funciona en otros tejidos para eliminar patógenos mientras limita el daño tisular.
Fuente bibliográfica
Killing the Pathogen and Sparing the Placenta
Indira U. Mysorekar, Ph.D.
Department of Obstetrics and Gynecology and the Department of Pathology and Immunology, Washington University in St. Louis School of Medicine, St. Louis.
N Engl J Med 2020; 383:2080-2082