D614G: antígeno candidato contra Covid-19
Recientes análisis de la mutación D614G en la proteína spike del SARS-CoV-2 arrojan información sobre un mecanismo subyacente a la infectividad relativamente aumentada de los viriones que la expresan, lo que podría tener importantes implicaciones en el diseño de vacunas.
La vacunación es el principal pilar del esfuerzo para contener y, en última instancia, poner fin a la pandemia por el coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2). Aunque se han desarrollado múltiples vacunas a una velocidad sin precedentes, la cantidad de programas fallidos o decepcionantes ilustra el desafío para montar una respuesta inmune protectora. Los antígenos de la vacuna ideal deberían dirigir la respuesta a la estructura más vulnerable del virión: la proteína spike durante la prefusión.
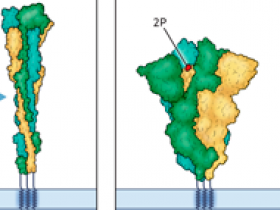
Esta proteína spike cataliza la fusión de los viriones con células huésped de una manera altamente coordinada. Se sintetiza como una única cadena polipeptídica que es escindida proteolíticamente por una furina proteasa en la subunidad 1 (S1) y la subunidad 2 (S2) durante el ensamblaje del virus. El dominio de unión al receptor (RBD) en S1 regula la unión a la enzima convertidora de angiotensina 2 (ACE2) que se expresa en la superficie celular del huésped, mientras que S2 contiene elementos críticos necesarios para la fusión. Los viriones tienen trímeros de spike funcionales en una conformación de prefusión metaestable (es decir, un estado de larga duración que no ha alcanzado el mínimo de energía favorable). La unión al receptor ACE2 estabiliza los RBD en la configuración al receptor. Aunque el mecanismo molecular y el orden de los eventos durante la fusión del SARS-CoV-2 no se conoce en detalle, está claro que la fusión requiere una mayor maduración proteolítica de S2 por las proteasas endosomales o de la superficie celular, así como la disociación de S1 de S2. Después de estos pasos, se cree que el péptido de fusión hidrófobo de S2 se inserta en la membrana de la célula huésped. Los cambios estructurales que siguen permiten que el trimérico S2 adopte una conformación de menor energía que pone a la membrana viral en estrecho contacto con la membrana de la célula huésped. Esto finalmente da como resultado la fusión de las dos membranas.
Durante la vida de los viriones del SARS-CoV-2 y en las preparaciones de laboratorio de la proteína spike trimérica, una fracción considerable experimenta prematuramente cambios de forma espontánea, en ausencia de ACE2 y sin catalizar la fusión. Debido a que estos pasos son irreversibles, las proteínas en la conformación de posfusión ya no pueden catalizar la fusión, lo que reduce la infectividad. Es importante destacar que la proteína spike es el principal objetivo de los anticuerpos neutralizantes en personas infectadas o vacunadas. La conformación de prefusión representa el objetivo más relevante, porque los anticuerpos pueden interferir con éxito con la infección solo si evitan la unión a las células o previenen la fusión en sí. Por tanto, la mayoría de los diseños de vacunas incluyen modificaciones de los aminoácidos en la proteína spike. Por ejemplo, las sustituciones con prolina estabilizan las conformaciones de prefusión y alteran el sitio de escisión de furina (figura 1).
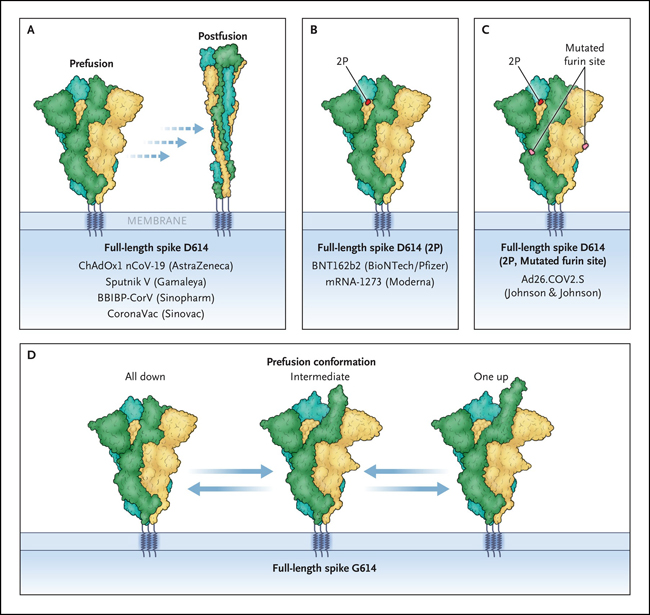
Figura 1: estrategias para estabilizar la conformación de prefusión de la proteína spike del SARS-CoV-2.
Las vacunas aprobadas contra el SARS-CoV-2 se basan en la variante D614 original y codifican o contienen proteínas spike de longitud completa no modificadas, que son propensas a adoptar la conformación posfusión incluso en ausencia de la enzima convertidora de angiotensina-2 (panel A), o mutantes que estabilizan la conformación de prefusión en una configuración descendente de los dominios de unión a todos los receptores (RBD) (paneles B y C). Estas variantes incluyen a spike de longitud completa con las mutaciones K986P y V987P (etiquetadas como "2P") (panel B) y a spike de longitud completa 2P con el sitio de escisión de furina mutado (R682S y R685G, etiquetado como "sitio de furina mutado") (panel C). Spike G614 de longitud completa exhibe una conformación de prefusión estable que puede adoptar una configuración con un estado hacia abajo (todos los RBD hacia abajo), intermedio (un RBD en estado intermedio) o hacia arriba (un RBD en estado hacia arriba) y, por tanto, constituye un prometedor antígeno para una vacuna (panel D).
A fines de febrero de 2020, se identificó una mutación puntual en la proteína spike de SARS-CoV-2, la variante D614G. La presencia de esta modificación predice la sustitución del aminoácido aspartato en la posición 614 (D614) por glicina (G614). Unos meses más tarde, esta variante del virus se había convertido en la forma dominante, sugiriendo que D614G confiere una ventaja evolutiva. Hay que destacar que G614 se encuentra en todas las formas actuales de interés. Trabajos anteriores han sugerido que G614 permite que el RBD de la proteína spike adopte fácilmente configuraciones en las que uno de los RBD está en estado activo, configuración que es compatible con la unión de ACE2.
En un estudio reciente, Jun Zhang y colegas dilucidaron la estructura de los trímeros de spike que contienen D614 o G614. En la mayoría de los ensayos anteriores, los investigadores resolvieron las estructuras de una versión de spike: el dominio transmembrana se reemplazó por un dominio de trimerización artificial y se introdujeron mutaciones estabilizadoras para evitar la división de spike y los cambios conformacionales (mutaciones 2P). Los autores resolvieron las estructuras de la proteína no modificada, incluido el dominio transmembrana. Solubilizaron la molécula con la ayuda de detergentes, lo más cerca que se puede llegar a la estructura nativa sin preservar la bicapa lipídica. La proteína D614 era menos estable y una fracción sustancial de las moléculas asumió la conformación posfusión, con S1 separado de spike trimérica. Por el contrario, G614 se encontró predominantemente en la conformación de prefusión sin apenas signos de activación prematura. En consecuencia, una fracción mayor de proteínas de spike G614 en la superficie de los viriones se encuentra en la conformación de prefusión, lo que hace que las partículas víricas sean más infecciosas.
Para comprender el origen molecular de esta beneficiosa estabilización, los autores compararon los detalles estructurales de las dos variantes. Los trimeros spike G614 se encontraron en una de tres configuraciones: todos los RBD en estado hacia abajo, un RBD en estado intermedio o un RBD en estado hacia arriba. Las dos últimas configuraciones no fueron adoptadas con frecuencia por spike D614, quizás porque las configuraciones de RBD hacia arriba en D614 hicieron que spike tuviera más probabilidades de experimentar la transición completa a la conformación posfusión. Es importante destacar que el aminoácido glicina relativamente pequeño en la posición 614 permitió que un bucle que contiene el aminoácido 630 adoptara una estructura plegada que encaja en una pequeña hendidura cerca de la interfaz de S1 y S2. Este elemento estructural no se observa en la estructura D614 y contribuye a la estabilización de la conformación de prefusión. Al proporcionar interacciones adicionales, el "bucle 630" plegado evita el desprendimiento de S1 y, de manera más general, mantiene los trímeros spike en la conformación de prefusión competente para la fusión. Este bucle debe desarrollarse en al menos dos de los tres protómeros de spike para exponer un RBD con configuración ascendente, un requisito para la unión de ACE2. La adopción de la conformación posfusión probablemente requiera el despliegue de los tres bucles 630. Por lo tanto, las barreras cinéticas separan las diferentes configuraciones, prolongando el tiempo de muestreo de las conformaciones de prefusión y minimizando el riesgo de desencadenar accidentalmente cambios irreversibles que conducen a la conformación de posfusión.
Las variantes del SARS-CoV-2 con mutaciones G614 son igualmente vulnerables a la neutralización por anticuerpos monoclonales terapéuticos o a la neutralización por sueros de pacientes después de una infección o vacunación. La pronunciada estabilización de la conformación de prefusión de spike G614 sin RBD o con un RBD ascendente proporciona ventaja evolutiva debido a la mayor infectividad de los viriones; los autores proporcionan una explicación molecular para este fenómeno. Spike G614 sería un antígeno formidable para futuras vacunas, porque la conversión prematura a la conformación posfusión es limitada y porque es propenso a adoptar la configuración hacia arriba de uno RBD relevante.
Fuente bibliográfica
Spike D614G - A Candidate Vaccine Antigen Against Covid-19
Paul-Albert Koenig, Ph.D., and Florian I. Schmidt, Ph.D.
Institute of Innate Immunity and the Core Facility Nanobodies, Medical Faculty, University of Bonn, Bonn, Germany.
N Engl J Med 2021; 384:2349-2351