Autofagia en el cáncer: ¿bueno o malo?
La visualización de autofagosomas en células que mueren ha permitido creer que la autofagia es una forma no apoptótica de muerte celular programada. Este concepto se ha evaluado utilizando células y organismos genéticamente deficientes para la autofagia. La mayoría de la evidencia disponible al respecto indica que, al menos en las células con maquinaria apoptótica intacta, la autofagia es ante todo un proceso de supervivencia más que un mecanismo de muerte. Ahora, con nuevas herramientas para evaluar la causalidad, es momento oportuno para revisar el caso de la autofagia en la muerte celular.
Por ejemplo, la autofagia puede proteger contra el cáncer mediante la captura de orgánulos dañados, permitiendo la diferenciación celular, aumentando el catabolismo de proteínas y/o la promoción de la muerte celular autofágica. Alternativamente, también podría contribuir al cáncer al favorecer la supervivencia de células que están privadas de nutrientes. Los datos más recientes son más consistentes con un modelo en que la autofagia contribuye a la supresión de tumores y defectos durante la oncogénesis.
Muerte tumoral, autofagia e inmunidad
Durante estos años, la quimioterapia efectiva y curativa ha sido un objetivo importante de la medicina, aunque muchos agentes de reciente desarrollo sólo han conducido a mejoras modestas respecto a la supervivencia. Así, son pocos los tratamientos desarrollados durante el último cuarto de siglo para curar neoplasias avanzadas - quizás debido a la atención en cómo las drogas eliminan las células cancerosas sin considerar el cómo influye la función de las células tumorales y su muerte en la respuesta del paciente. Puede ser que el estado funcional de una célula tumoral sea tan importante como su forma de perecer.
El sistema inmune del huésped puede regular la progresión maligna, y la expresión de las células del sistema inmune y las citocinas o quimiocinas dentro de los tumores, lo que está directamente asociado con el resultado clínico en los diversos cánceres. Sin embargo, muchos agentes quimioterapéuticos eliminan las células inmunes y con ello limitar la eficacia de las respuestas inmunes. Por otra parte, los objetivos de las respuestas inmunes emergentes en pacientes tratados con quimioterapia no son bien conocidos y por lo tanto no se pueden medir fácilmente. Tal vez por estas razones, la relación entre la quimioterapia eficaz y la inducción de inmunidad protectora ha recibido poca atención.
Un reciente estudio de Mickaël Michaud y colaboradores (Science 2011; 334:1573-7) proporciona un intento de acercamiento a esta problemática. Esto demuestra que el proceso de autofagia, una forma programada de supervivencia celular, es fundamental para la respuesta inmune antitumoral inducida por las células tumorales que sucumben. Por lo tanto, este proceso implica un vínculo fundamental entre la quimioterapia efectiva y las respuestas inmunes contra el cáncer derivadas del paciente.
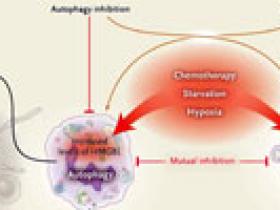
La autofagia es uno de los dos mecanismos antagónicos por el cual las células responden al estrés, el otro es la apoptosis, o muerte celular programada (fig. 1). Como las células tumorales sobre-regulan las proteínas antiapoptóticas, y pierden la función de las moléculas pro-apoptóticas tales como p53, mantienen la expresión de la proteína nuclear pro-autofágica denominada proteína del grupo 1 de alta movilidad (HMGB1), así como también una mejor capacidad de autofagia. Por consiguiente, cuando las células tumorales que realizan autofagia mueren, los mecanismos de remoción de la inmunidad se presentan como un grupo de señales que guían los futuros acontecimientos.
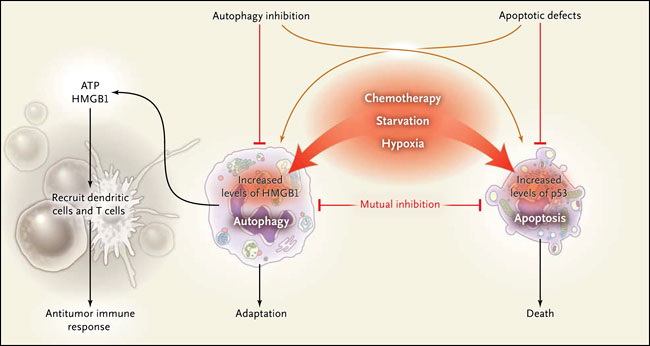
La inducción de la autofagia en células cancerosas por la quimioterapia puede conducir a inmunidad en los tumores trasplantables. Mayores niveles de autofagia en células tumorales pueden ser inducidos por la quimioterapia, radioterapia u otros factores de estrés celular, como la hipoxia y falta de nutrientes. La autofagia implica la incorporación de contenidos intracelulares, que se degradan después del transporte y la fusión a un lisosoma para liberar aminoácidos, nucleótidos, trifosfato de adenosina (ATP) y lípidos, todos elementos importantes para el anabolismo y la supervivencia. La liberación de ATP en el medio extracelular permite reclutar células dendríticas, así como células T CD4+ y CD8+, dando como resultado la inmunidad antitumoral. La inducción farmacológica de la autofagia o la liberación de ATP en las células tumorales durante la la respuesta inmune podría promover una eficaz inmunidad antitumoral.
En los estudios realizados durante las últimas tres décadas, la autofagia ha demostrado ser una respuesta a los factores de estrés que incluyen la hipoxia y la inanición, las cuales se encuentran frecuentemente en los tumores. De hecho, la autofagia se observa en los cánceres establecidos, pero su inhibición a principios de la carcinogénesis promueve la progresión del tumor, lo que sugiere que un interruptor estimula la transición de un tumor en un estado de adicción a la autofagia para mantener la viabilidad de la hipoxia.
Los tumores utilizan la autofagia como un mecanismo de auto-protección. En tales casos, mueren como consecuencia de una excesiva autodestrucción. La investigación de M. Michaud y colegas encontró que los efectos de la quimioterapia inicial en dos tumores distintos trasplantados en ratones, cáncer colorrectal y sarcoma, dependen de que las células sean capaces de aumentar los niveles basales de autofagia. La administración de dos fármacos quimioterapéuticos, mitoxantrona y oxaliplatino, permite la infiltración del tumor mediante la presentación del antígeno de las células dendríticas y células T citotóxicas en las células tumorales. El equipo de investigadores llegó a demostrar que durante la liberación de adenosina trifosfato (ATP) al morir, las células competentes eran fundamentales para la inducción de una inmunidad antitumoral protectora. También se observó la liberación celular de ATP en las respuestas autofágicas e inmunes hacia los patógenos. El ATP es un patrón molecular asociado a daño (DAMP, por sus sigla en inglés), una señal de peligro que avisa al sistema inmune de la presencia de lesión en los tejidos y de agentes microbianos potencialmente peligrosos. De acuerdo con estos conceptos, M. Michaud encontró que la inmunidad adaptativa inducida por quimioterapia contra tumores transplantables deficientes en autofagia es promovida por la introducción de ATP exógeno o el uso de inhibidores de la ATPasa.
Estas observaciones ponen de relieve la importancia de comprender cómo los tumores surgen y son tratados a través de vías inflamatorias e inmunes. Queda mucho trabajo para determinar si la autofagia puede ser utilizada para que sus efectos mejoren la inmunidad en el contexto de la apoptosis inducida por quimioterapia y así poder modificar los resultados clínicos. Los estudios sobre autofagia e inmunidad han producido resultados contradictorios. Los que se describen aquí, mediante el uso de tumores trasplantables tratados en los primeros días después de la implantación, pueden no ser aplicables a tumores resistentes a la quimioterapia que han interactuado con el sistema inmune del huésped durante muchos años. También podrían considerarse otros mecanismos ya descritos, como la producción del factor de crecimiento transformante beta u otras citoquinas o ciertas prostaglandinas, como la E2, que suelen afectar la inmunidad. De hecho, los mismos factores que ayudan a iniciar la respuesta inmune, como el ATP y HMGB1, también fomentan, a finales de la progresión tumoral, la incorporación y el mantenimiento de células supresoras de origen mieloide inmunosupresivas y células T reguladoras, favoreciendo así el crecimiento del tumor. Las actuales estrategias diseñadas para inhibir la autofagia durante la inmunoterapia, la quimioterapia o la radioterapia, deberían ser consideradas para incluir la respuesta inmunológica antitumoral.
Fuente bibliográfica
Tumor-Cell Death, Autophagy, and Immunity
Louis M. Weiner, M.D., and Michael T. Lotze, M.D.
Lombardi Comprehensive Cancer Center, Department of Oncology, Georgetown University, Washington, DC, USA.
N Engl J Med. 2012 Mar 22; 366(12):1156-8