Revascularización tejidos isquémicos
Angiogénesis terapéutica: realidad y ficción
La isquemia cerebral, del corazón y de las extremidades es una de las principales causas de morbilidad y mortalidad en todo el mundo. La hipoxia estimula la secreción del factor de crecimiento endotelial vascular (FCEV) y otros factores angiogénicos, dando lugar a neovascularización y la protección contra la lesión isquémica. La angiogénesis es el proceso de neoformación vascular que ocurre durante el desarrollo embrionario y la vida extrauterina. La angiogénesis terapéutica no es más que la utilización de este proceso fisiológico intentando controlarla en espacio, tiempo y forma.
Se acaba de demostrar que el co-activator transcripcional PGC-1-alfa, un potente sensor y regulador metabólico, es inducido por la falta de nutrientes y oxígeno, regulando poderosamente la expresión del FCEV y la angiogénesis en células musculares cultivadas y en músculo esquelético in vivo. También se ha observado que ratones carentes de PGC-1-alfa muestran una sorprendente falta de capacidad para reconstituir el flujo sanguíneo de manera normal a las extremidades después del daño isquémico, mientras que la expresión transgénica de PGC-1-alfa en el músculo esquelético es protectora. Sorprendentemente, la inducción de FCEV por PGC-1-alfa no implica una respuesta automática a la hipoxia o al factor inducible de hipoxia. En lugar de ello, PGC-1alpha co-activa el receptor nuclear huérfano ERR-alfa (estrógenos relacionados con el receptor alfa) en sitios de unión altamente conservados que se ubican en el promotor y en un intrón del gen FCEV.
Por lo tanto, PGC-1alpha y ERR-alfa, los principales reguladores de la función mitocondrial en respuesta al ejercicio y otros estímulos, también controlan una nueva vía angiogénica que necesita oxígeno y sustratos. PGC-1-alfa podría convertirse en una novedosa diana terapéutica para el tratamiento de las enfermedades isquémicas.
Metabolismo y angiogénesis terapéutica
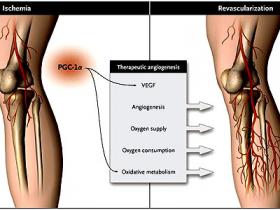
A pesar de las grandes expectativas, la angiogénesis terapéutica con el factor de crecimiento endotelial vascular (FCEV) y moléculas relacionadas en el tratamiento de la isquemia cardíaca y de la enfermedad arterial periférica oclusiva, ha fracasado en la clínica, por lo que es necesario establecer estrategias alternativas para estimular la revascularización de los tejidos isquémicos. Zoltan Arany y colaboradores (Nature. 2008 Feb 21; 451(7181):1008-12) informaron recientemente que el sensor metabólico coactivador 1-alfa del receptor gamma activado del proliferador de peroxisomas (PGC-1-alfa) estimula la angiogénesis en los tejidos isquémicos (figura 1). Con este trabajo, los autores han fortalecido el emergente vínculo entre la angiogénesis y el metabolismo, dos procesos que están estrechamente entrelazados. El estudio del grupo de Z. Arany también podría ofrecer nuevas oportunidades terapéuticas para la enfermedad isquémica.
Durante miles de millones de años de evolución, para sobrevivir, los organismos se han convertido en dependientes del oxígeno debido a su alto potencial energético. En especies avasculares, como el platelminto o la mosca de la fruta, el oxígeno simplemente difunde del medio ambiente a todas las células vía conductos respiratorios. Otras especies, por el contrario, han desarrollado una red vascular para entregar el elemento gaseoso y los nutrientes a las células. Debido a su eficiencia, el metabolismo aeróbico es el camino preferido para la generación de energía. Sin embargo, cuando este suministro se ve limitado (por ejemplo, en la oclusión de los vasos), las células son capaces de cambiar al metabolismo anaeróbico, el cual es menos eficiente. Los mecanismos han evolucionado para restablecer el suministro, y garantizar que el consumo de oxígeno se mantenga en un estrecho equilibrio con la entrega y así satisfacer las necesidades metabólicas de los tejidos. Arany y colegas han descubierto que algunos reguladores del metabolismo pueden hacer esto mediante la “apropiación” de la actividad angiogénica y, por ende, iniciar la angiogénesis (y el suministro de oxígeno) y el metabolismo oxidativo (que implica consumo de oxígeno). Este proceso es distinto de aquellos que involucran los clásicos factores angiogénicos, que estimulan sólo la revascularización y no los cambios metabólicos adicionales (figura 1).
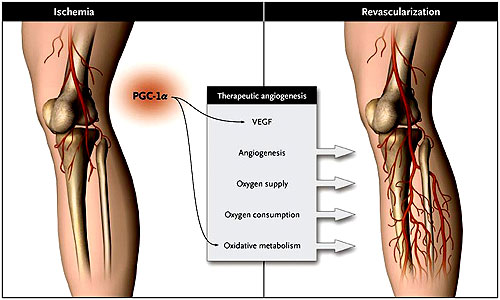
A diferencia de la angiogénesis terapéutica clásica con el factor de crecimiento endotelial vascular (FCEV) y factores relacionados, el tratamiento angiogénico con el coactivador 1-alfa del receptor gamma activado del proliferador de peroxisomas (PGC-1-alfa) no sólo estimula la angiogénesis impulsada por FCEV, sino que también el metabolismo oxidativo, restaurando la función normal del tejido. A través del "secuestro" de FCEV, PGC-1-alfa prepara el tejido isquémico para la generación eficiente de energía mediante el metabolismo oxidativo anticipando la revascularización.
¿Cómo puede un sensor metabólico regular la angiogénesis? ¿La actividad angiogénica es atractiva para uso clínico? En respuesta a las necesidades cada vez mayores para la producción de energía celular, como en el ejercicio y ayuno, PGC-1-alfa impulsa la respiración mitocondrial por coactivación de una serie de factores de transcripción. Usando una combinación de ensayos celulares y ratones modificados genéticamente que sobre-expresan o bien inhiben a PGC-1-alfa, Z. Arany y colaboradores pusieron de manifiesto que PGC-1-alfa también sobre-regula la liberación del factor angiogénico FCEV y estimula la revascularización de los tejidos isquémicos, por lo tanto, promueve un mejor suministro de oxígeno y eleva la tasa metabólica oxidativa. Por otra parte, PGC-1-alfa también regula otros factores angiogénicos que en conjunto deben estimular la maduración de los vasos (además de la generación capilar) y, por ende, la perfusión. Debido a que PGC-1-alfa sólo promueve la angiogénesis en la enfermedad, y no en estados saludables, tiene un atractivo perfil de seguridad en la angiogénesis terapéutica. No es de extrañar, ya que la angiogénesis es un proceso complejo que requiere un estricto control, que otros factores metabólicos tengan actividad pro-angiogénica o anti-angiogénica, ya sea mediante la regulación de la liberación de señales angiogénicas o afectando directamente a las células endoteliales. Algunos factores, actúan incluso como supresores de hemangiomas, pero su función y uso clínico siguen siendo en gran medida inciertos.
A primera vista, parece evidente que el tratamiento de la enfermedad isquémica debe implicar una mejora en el suministro de oxígeno y, por ende, de su consumo, pero un reciente estudio de J. Aragonés y colaboradores (Nat Genet. 2008 Feb;40(2):170-80) indicó que la estrategia opuesta, es decir, inducción de tolerancia a la hipoxia mediante la promoción de la conservación de oxígeno en lugar del consumo (similar a lo que hacen los animales cuando hibernan), también podría ofrecer beneficios terapéuticos.
¿Habría riesgo en el tratamiento de los tejidos isquémicos con PGC-1-alfa? ¿Podría PGC-1-alfa aumentar el consumo de oxígeno prematuramente, antes de que nuevos vasos puedan suministrar oxígeno, y, por tanto, agravar la isquemia? Obviamente, la actividad metabólica y angiogénica tendría que estar estrechamente coordinadas, y cualquier intervención terapéutica dirigida a PGC-1-alfa debe tener en cuenta sus acciones pleiotrópicas. Los tumores a menudo son hipóxicos y metabolizan el combustible anaeróbicamente. ¿Cómo participa PGC-1-alfa en el interruptor angiogénico que transforma un pequeño tumor avascular en un gran cáncer vascularizado? ¿Podría PGC-1-alfa inhibir la mejora o agravar el resultado clínico global? ¿PGC-1-alfa puede impedir el crecimiento de los vasos en la enfermedad ocular, sin causar efectos adversos en los fotorreceptores metabólicamente activos? Cuando una célula se encuentra sobrecargada con nutrientes, ¿se apagará su suministro vascular y se convertirá en isquémica, agravando las complicaciones de los trastornos metabólicos?
Independientemente de estas cuestiones pendientes, la conciencia de que las células “hambrientas” de energía la busquen a través del secuestro angiogénico, ofrece excitantes oportunidades para la fusión de dos áreas de estudio y diseño de nuevos enfoques terapéuticos.
Fuente bibliográfica
Metabolism and Therapeutic Angiogenesis
Peter Carmeliet, M.D., Ph.D., and Myriam Baes, Ph.D.
Vesalius Research Center, VIB-KU Leuven, Leuven, Belgium.
N Engl J Med. 2008 Jun 5;358(23):2511-2