Vacunas de ARN, un potenciamiento necesario
Recientemente se ha descrito en modelos preclínicos un potente enfoque de formulaciones vacunales basado en un novedoso sistema de vectores duales que utilizan un sistema plasmidial de ADN y un ARN con capacidad de autoamplificarse, combinando las ventajas de un producto de ácido nucleico de ADN más estable con los mayores niveles de expresión de antígenos de las vacunas de ARN para obtener respuestas inmunitarias más fuertes que las alcanzadas con vacunas convencionales. Este constructo molecular es capaz de codificar un antígeno de interés, proporcionando una expresión de 10 a 100 veces mayor que un ARN mensajero convencional. Al evaluar este nuevo sistema en ratones, se observa que dosis de ARN codificante para antígenos de hemaglutinina de influenza de tan solo 50 ng eran suficientes para inducir anticuerpos neutralizantes y montar una respuesta inmunológica protectora contra un posterior desafío utilizando cepas virales no atenuadas. Estos hallazgos, junto con el favorable perfile de seguridad del sistema basado en vectores, evidencian un proceso con aplicabilidad para diversos patógenos, lo que justifica una mayor exploración de los ARN con capacidad de autoamplificación para el desarrollo de formulaciones eficaces y así satisfacer la demanda mundial de vacunas.
Transamplificación
A partir de 1990, la inyección directa de ARN o ADN en músculos de ratones dio lugar a la expresión in vivo de proteínas codificadas por el ácido nucleico inyectado (DOI: 10.1126/science.1690918). Este hallazgo, junto con los estudios que muestran la obtención de respuestas inmunitarias y protección contra la infección mediante el suministro de ADN que codifica proteínas de los patógenos en la piel o el músculo de animales, sembró el campo de la vacunología de manera que solo era necesaria la secuencia de un gen para crear una vacuna. Los primeros estudios demostraron que tanto las vacunas de ADN como de ARN inducían respuestas inmunitarias. La administración por medio de plásmidos (una pequeña molécula circular de ADN extracromosómico) surgió inicialmente como la estrategia dominante, y aunque los primeros estudios clínicos en seres humanos fueron en su mayoría decepcionantes, los avances en la administración y en la incorporación de secuencias inmunoestimuladoras (adyuvantes genéticos) han impulsado nuevos ensayos clínicos y han servido de base para estrategias de desarrollo de vacunas contra el SARS-CoV-2, agente etiológico de la COVID-19.
El interés reciente en las vacunas de ARN mensajero (ARNm) ha sido alimentado por métodos que aumentan tanto la estabilidad de esta molécula como la producción de proteínas, además de mejorar la entrega. Estos métodos incluyen el uso de nucleósidos modificados, pero también el desarrollo de tecnologías de nanopartículas que estabilizan el ARNm, aumentan la captación celular y mejoran la biodisponibilidad del ARNm una vez que está dentro de la célula. Se considera que evitar el riesgo de integración en el genoma del hospedero es una ventaja comparativa del ARNm (con respecto a las vacunas de ADN), aunque amplios estudios han atenuado esta preocupación. Una clara ventaja de las vacunas de ARNm es que no necesitan entrar en el núcleo para expresar el antígeno. En cambio, una vez dentro del núcleo, una vacuna de ADN producirá muchas copias de las moléculas de ARNm, lo que dará lugar a la producción de más antígeno por cada célula transfectada. Por lo tanto, sería interesante lograr que las vacunas de ARN se autoamplifiquen, estrategia que precisamente ha sido descrita por Tim Beissert y colaboradores de la Johannes Gutenberg-Universität Mainz (Alemania) con la finalidad de aumentar el rendimiento de los antígenos expresados por las vacunas de ARNm (DOI: 10.1016/j.ymthe.2019.09.009).
Las vacunas de ARN autoamplificadas se derivan de la columna vertebral del genoma de un alfavirus en el que los genes que codifican la maquinaria de replicación del ARN viral están intactos, pero los que codifican las proteínas estructurales virales se sustituyen por un transgén que codifica el antígeno de la vacuna. Una vacuna de ARN autoamplificante puede administrarse en forma de ADN plásmido, ARN de tipo viral y ARN transcrito in vitro (figura 1) y puede provocar respuestas inmunológicas sustancialmente más fuertes que el ARNm. Las vacunas de ARN autoamplificantes a base de plásmidos de ADN combinan las ventajas de un producto de ácido nucleico de ADN más estable con los mayores niveles de expresión de antígenos de las vacunas de ARN autoamplificantes para obtener respuestas inmunitarias más fuertes que las alcanzadas con vacunas de ADN convencionales en modelos preclínicos.
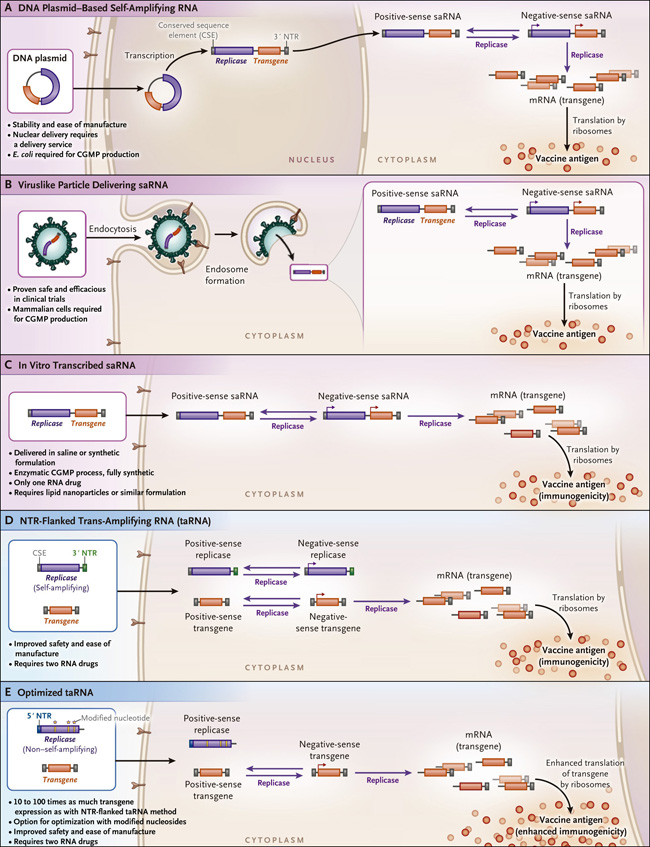
Figura 1. Expresión de antígenos por el ARN del replicador alfaviral.
El ADN plasmidial lleva los genes de la replicasa viral y el transgén (que codifica el antígeno de la vacuna) al núcleo, donde se transcribe, generando el ARN replicón (la parte que codifica las proteínas de la replicasa). El ARN replicón se transporta entonces al citoplasma, al que le sigue la autorreplicación del ARN (también llamada autoamplificación), la producción de ARN mensajero (ARNm) y la traducción del antígeno de la vacuna (rojo) (panel A). Las partículas de ARN tipo viral que se producen en un paso de empaque separado (no se muestra) entregan el ARN replicón al citoplasma por medio de endocitosis mediada por receptores (recuadro B). El ARN replicón transcrito in vitro se entrega a las células ya sea en una solución salina o en formulaciones sintéticas (panel C). Común a cada enfoque, el complejo de proteínas de la replicasa se traduce desde los dos tercios anteriores del genoma del ARN replicón (púrpura). La replicasa inicia la transcripción de una cadena negativa (-ARN) mediada por la ARN polimerasa dependiente de ARN utilizando la región no traducida (NTR) 3′ (verde) y, utilizando el -ARN como plantilla. También transcribe una cadena positiva (+ARN) desde la región NTR 5′ (verde), así como un promotor subgenómico (flecha) para iniciar la transcripción en ARNm. Muchos antígenos (Ag) son traducidos directamente del ARNm por los ribosomas citoplasmáticos. Recientemente Tim Beissert y sus colegas describieron una estrategia dual (DOI: 10.1016/j.ymthe.2019.09.009) en la que un ARN replicón codifica la maquinaria de la replicasa "en trans" al ARN codificador de antígenos coadministrado (panel D). Los autores encontraron inmunogenicidad cuando los genes de la replicasa estaban flanqueados por regiones NTR para facilitar la replicación intracelular (recuadro E). Observaron una mayor inmunogenicidad cuando los genes de la replicasa se optimizaron para la eficiencia de la traducción (y carecían de regiones flanqueantes). CGMP denota actuales procesos de buena fabricación, y E. coli Escherichia coli.
Beissert y sus colegas describen una estrategia basada en dos vectores de ARN: uno que contiene el gen que codifica la replicasa y el otro que codifica el antígeno. Por lo tanto, la maquinaria de la replicasa está provista "en trans" (es decir, dos genes que actúan juntos pero en ARN diferentes) por un ARN autoamplificante o un ARNm no replicante y media la replicación del ARN que codifica el antígeno. Los autores evidenciaron la inducción de respuestas robustas y protectoras de anticuerpos neutralizantes en ratones después de inmunizarlos con el ARN codificador de antígenos que expresan la proteína hemaglutinina del virus influenza en dosis de nanogramos, aunque se requería un número comparativamente elevado de ARN codificante de replicasa. Este enfoque ofrece ventajas fundamentales, en comparación con las vacunas de ARN autoamplificantes convencionales, en cuanto a su potencial para aumentar la seguridad, capacidad de fabricación y facilidad de optimización. La ventaja en materia de seguridad se deriva del hecho de que el uso de dos ARN separados evita el riesgo del uso de ARN autoamplificantes que se elaboran para expresar glicoproteínas virales que, en teoría, podrían llegar a las vesículas extracelulares y transferirse a nuevas células. En cuanto a la capacidad de fabricación, la producción en mayor escala puede ser un desafío para los transcritos de ARN muy largos, como los ARN autoamplificantes, mientras que el enfoque de la transamplificación permite longitudes más cortas de ARN, aunque con dos posibles inconvenientes: el requisito de fabricar dos fármacos ARN y la complejidad añadida que se debe a la necesidad de una entrega eficiente in vivo de ambos en la misma célula. Por último, como señalan los investigadores, este enfoque puede mejorarse aún más aplicando nuevas estrategias en la tecnología del ARNm, como las modificaciones de nucleósidos, secuencias estabilizadoras y optimización de los codones de todo el gen del replicón, estrategias que todavía no son posibles para el ARN autoamplificante convencional.
Con la aparición de la pandemia por COVID-19, una vacuna de ARNm fue la primera en entrar en ensayos clínicos, y los primeros voluntarios recibieron la vacuna en las 10 semanas siguientes a la publicación de la secuencia genética del SARS-CoV-2. Las vacunas de ácido nucleico son ahora una gran esperanza para resolver esta crisis pandémica. Esto no es ninguna sorpresa. Desde su primera concepción, las vacunas de ácidos nucleicos fueron reconocidas como una posible solución para una rápida respuesta a una pandemia. La necesidad de solo la secuencia del patógeno para generar la vacuna y su simplicidad en la fabricación han sido reconocidas desde hace mucho tiempo como una gran ventaja para la entrega de una respuesta rápida a una epidemia emergente. La capacidad de las vacunas de ARN autoamplificantes, y ahora de las vacunas de ARN transamplificantes, de proporcionar una producción amplificada y duradera del antígeno in vivo, junto con las potentes propiedades inmunoestimulantes innatas inherentes, se suma a estas facultades y puede traducirse en el ahorro de dosis (es decir, obtener las mismas respuestas inmunitarias con dosis más pequeñas de vacuna) que probablemente se necesitará para satisfacer la demanda mundial. Solo podemos esperar que su despliegue convierta la crisis sanitaria de COVID-19 en un desafío más manejable, salvando vidas y disminuyendo la morbilidad.
Fuente bibliográfica
Amplifying RNA Vaccine Development
Deborah H. Fuller, Ph.D., and Peter Berglund, Ph.D.
Department of Microbiology, University of Washington School of Medicine (D.H.F.), and HDT Bio (P.B.) — both in Seattle.
DOI: 10.1056/NEJMcibr2009737