Un descubrimiento original: el selenio en la enfermedad de Keshan
La enfermedad de Keshan fue descubierta en el invierno de 1935 en el noreste de China, cuando al brote de una afección desconocida se produjo con la aparición repentina de opresión y dolor precardial, náuseas y vómitos, y finalmente la muerte de los afectados. Respecto a lo anterior, extensas estudios epidemiológicos transversales han demostrado que bajas concentraciones de selenio en granos de los cereales y en los residentes locales se ligaban directamente a la aparición del trastorno cardíaca congestivo. También se ha podido definir que la administración oral de comprimidos de selenita de sodio puede reducir significativamente su incidencia.
Deficiencia de selenio y selenoproteínas
El selenio es un importante oligoelemento para muchas funciones biológicas. La comprensión actual de sus roles biológicos celulares y moleculares proviene directamente de investigaciones sobre su papel en ciertas enfermedades. En 1958, Muth y colegas demostraron que la adición de selenio a la dieta protege contra el desarrollo de la enfermedad del músculo blanco en ovejas. En 1935, se reportó un brote fatal de cardiomiopatía progresiva en Keshan y los condados vecinos de la provincia de Heilongjiang en el noreste de China. Inicialmente, se creyó que la causa fue un proceso infeccioso agudo; sin embargo, cuando la enfermedad reapareció en 1960 en las provincias de Sichuan y Yunnan al sudoeste del mismo país, se consideraron explicaciones adicionales. Las muestras de tejido cardíaco obtenidas durante la autopsia de pacientes muertos a causa de la enfermedad de Keshan mostraban una palidez del miocardio como consecuencia de extensas fibrosis y necrosis, así como también de sarcolema por miocitólisis. Por esta razón, Zheng llegó a la conclusión en 1962 que había similitudes morfológicas entre la enfermedad de Keshan y la del músculo blanco.
La enfermedad del músculo blanco es un trastorno observado en el ganado que es criado en tierras con niveles bajos de selenio. La apariencia muscular de calcáreo que es característica de la condición es una consecuencia de la fibrosis y la deposición anormal de calcio. Esta observación patológica permitió explorar la posible relación entre la deficiencia de selenio y la enfermedad de Keshan. Extensos estudios epidemiológicos mostraron que los bajos niveles de selenio en el suelo y en productos alimenticios locales se correlacionaban con niveles bajos de selenio en sangre total y en muestras de pelo en residentes de zonas en donde la patología es endémica, en comparación con otras áreas de China. La información de algunos ensayos pilotos de reposición de selenio fue seguida de un estudio prospectivo que mostró la eficacia del tratamiento con selenita de sodio para prevenir la enfermedad de Keshan y mitigar las manifestaciones clínicas en estos pacientes. En respuesta a estos estudios, el gobierno implementó políticas nutricionales que promovieran la suplementación por vía oral, lo que prácticamente eliminó la enfermedad de Keshan en las zonas endémicas.
Estudios más recientes sugieren que el virus Coxsackie B3 puede ser un factor que contribuya a la enfermedad de Keshan y que la deficiencia de selenio tendría efectos adicionales de gran alcance. Esto último, ha demostrado exacerbar los efectos cardiopáticos de la enfermedad de Chagas y producir el equivalente de la enfermedad del músculo blanco en individuos con anorexia nerviosa tratados con nutrición parenteral sin suplementos de selenio. Por otra parte, la deficiencia de selenio también genera trastornos del sistema inmune (por ejemplo, inmunidad adaptativa disfuncional), del sistema reumatológico (por ejemplo, enfermedad de Kashin-Beck), sistema endocrino (por ejemplo, hipotiroidismo), y del sistema neurológico (por ejemplo, síndromes de epilepsia infantil); sin embargo, la fuerza epidemiológica de las asociaciones y mecanismos subyacentes varían en cada condición.
¿Cómo una carencia de este elemento causa tales efectos biológicos en seres humanos? Para abordar esta pregunta, hay que considerar en primer lugar si el selenio está activo en su forma inorgánica (derivados de selenita y redox) o necesita ser fijado orgánicamente para llevar a cabo sus acciones biológicas. Hornos y Jones mostraron por primera vez en 1941 que el oligoelemento se incorpora en el trigo como un complejo de aminoácidos que contiene azufre. Estudios posteriores de Trelease y colegas mostraron que esta molécula se transforma a Se-metilselenocisteína, una observación confirmada por Shrift y Virupaksha, los que también encontraron que esta forma deriva del selenito en plantas que acumulan selenio.
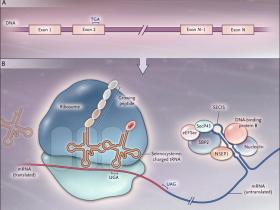
En estudios procariotas, los investigadores han cocluido que la actividad de las enzimas metabólicas claves, incluyendo la deshidrogenasa fórmica y glicina reductasa, requieren de selenito. Con la observación que el selenio previene el daño oxidativo en los eritrocitos y la posterior demostración de que este efecto se ejerce a través de la acción de la glutatión peroxidasa, se pudo establecer su papel como un componente crítico de la actividad antioxidante del sistema enzimático central. Un subsiguiente avance fue la de grupo de Thressa Stadtman, que encontró que la forma específica de selenio contenida en estas selenoproteínas es la selenocisteína (fig. 1), el ácido amino 21. Además el trabajo demostró que la selenocisteína reside dentro del sitio activo y centro catalítico de la glutatión peroxidasa; que no es ARN de transferencia conteniendo selenio (ARNt); que el ARNt cargado con selenocisteína deriva enzimáticamente en ARNt cargado de serina generado en un proceso en el que el selenio inorgánico es fosforilado por la selenofosfato sintetasa 2 para después añadirle una fosfoserina por la selenocisteína sintetasa para producir selenocisteína; y que el codón para la selenocisteína es TGA, que es un triplete de parada en proteínas que no contienen selenocisteína (fig. 2).
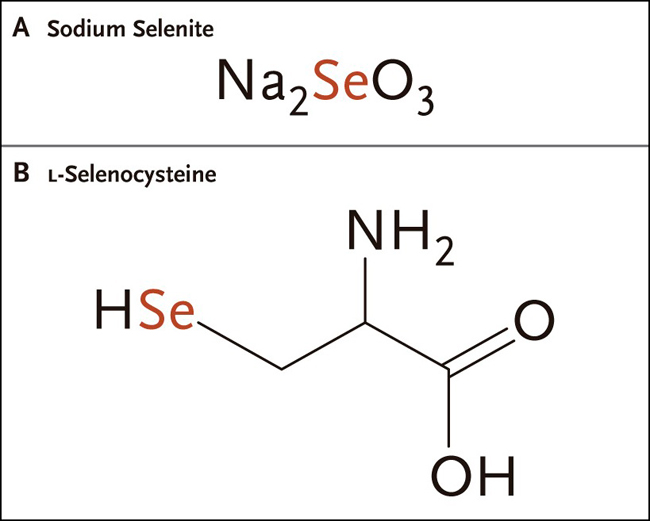
Figura 1: compuestos de selenio
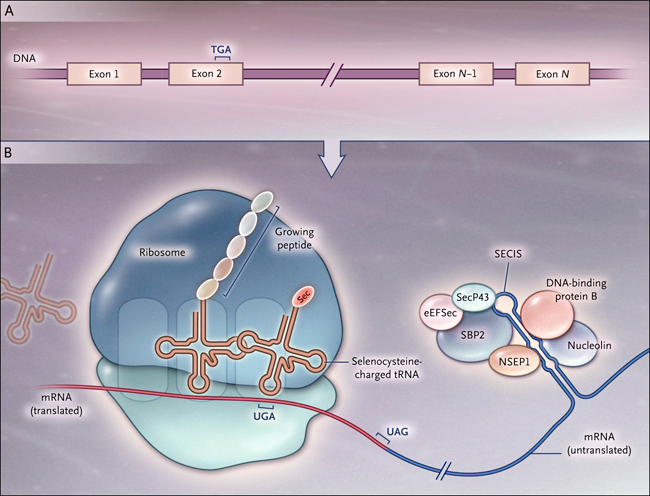
El panel A muestra al selenito de sodio, la forma inorgánica y primaria de selenio; el B muestra al aminoácido L-selenocisteína.
La traducción del codón UGA en selenocisteína es un proceso ineficiente. Si el ribosoma lee a través del codón de parada e incorpora selenocisteína o termina la traducción está determinado por factores que incluyen la disponibilidad de selenio fijado orgánicamente, de un grupo de cofactores de la traducción y una secuencia particular en la región 3' no traducida del ARN mensajero de la selenoproteína (secuencia de inserción para la selenocisteína [SECIS]). El papel de SECIS se demostró por primera vez gracias a los trabajos de Berry y colaboradores para otra selenoproteína, la deiodinasa yodotironina, que es importante para la normal función de la hormona tiroidea. Sobre la base de estas características, Kryukov y colegas utilizaron un análisis bioinformático para mostrar que el selenoproteoma humano incluye 25 selenoproteínas, muchas con funciones aún desconocidas. Por otra parte, un análisis de los proteomas de muchas especies condujo al equipo de Gladyshev a la conclusión que hubo una transición evolutiva desde selenocisteína a cisteína, posiblemente en respuesta a sus diferentes potenciales redox debido a la evolución de un ambiente más reductor a uno más oxidativo.
Entre las 25 selenoproteínas de mamíferos, la familia de la glutatión peroxidasa representa un grupo importante cuya función se conoce bien. Cada una de estas enzimas reduce los lípidos y los peróxidos de hidrógeno a alcoholes lipídicos y agua, respectivamente. La glutatión peroxidasa 1 (GPx-1) es la más común de las peroxidasas de glutatión y se encuentra en el citosol de todas las células, la glutatión peroxidasa 3 (GPx-3) es una enzima antioxidante clave en el medio extracelular, y la glutatión peroxidasa 4 (GPx -4) es un regulador esencial en la oxidación de membrana. Por último, la enzima antioxidante reductasa tiorredoxina es otra selenoproteína antioxidante; ésta reduce la forma oxidada de la tiorredoxina, reciclándola para la siguiente función redox.
Con esta gama de funciones antioxidantes con participación de las selenoproteína, ¿hay alguna evidencia directa de las consecuencias patobiológicos redox de su carencia? Una deficiencia en GPx-1 agrava la lesión por isquemia-reperfusión en cardiomiocitos y promueve la disfunción endotelial, así como de anormalidades estructurales en el miocardio. En pacientes con enfermedad de la arteria coronaria, la baja actividad GPx-1 en los eritrocitos es factor de riesgo independiente para eventos cardiovasculares futuros. Una deficiencia en GPx-3 conduce a un aumento de la trombosis dependiente de plaquetas como resultado de un aumento de la inactivación oxidativa del óxido nítrico. Un haplotipo hipofuncional en el gen promotor de GPx-3, en comparación con el (más prevalente) haplotipo normal, duplica el riesgo de accidente cerebrovascular en adultos jóvenes y niños. Mediante la reducción de los lípidos y la oxidación de las lipoproteínas, se cree que GPx-4 atenúa las acciones pro-aterotrombóticos de estas especies.
Tomados en conjunto, estos datos sugieren que hay una variedad de mecanismos que implican a las selenoproteínas antioxidantes (fig. 3) que conspiran para producir la cardiomiopatía de la enfermedad de Keshan. Debido a la importancia de muchas selenoproteínas en atenuar el estrés oxidativo en una variedad de compartimientos celulares, se puede concluir fácilmente que la deficiencia de selenio promueve el estrés oxidativo y las lesiones, y que también puede potenciar la lesión oxidante de otros factores patogénicos, incluyendo infecciones virales y otras.
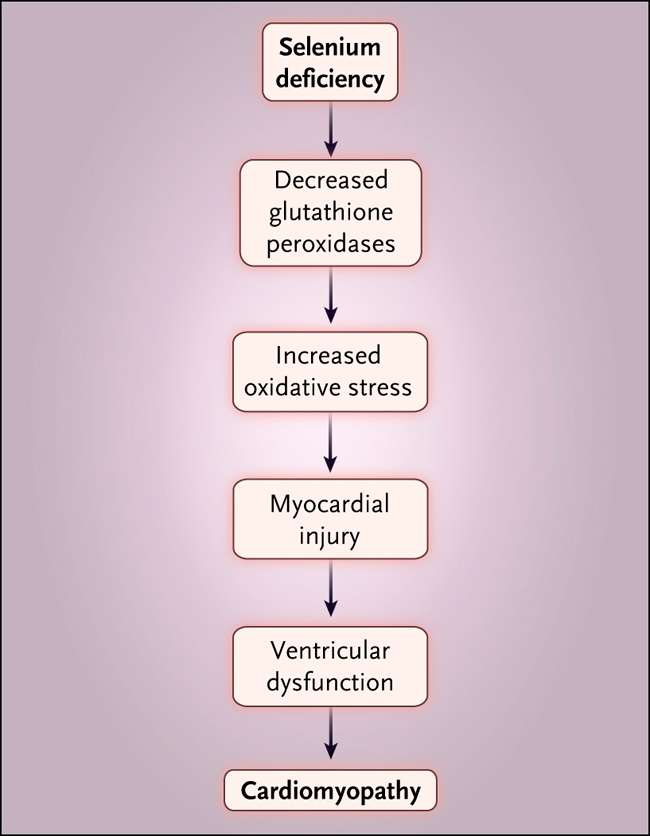
Las funciones del selenio en los procesos biológicos y patobiológicos están íntimamente relacionadas. La identificación de la deficiencia de selenio como causa de una enfermedad endémica ha permitido explorar tanto las propiedades biológicas fundamentales de las selenoproteínas como los eventos moleculares responsables del fenotipo patológico, demostrando una vez más la naturaleza bidireccional de la traducción biomolecular.
Fuente bibliográfica
Keshan Disease, Selenium Deficiency, and the Selenoproteome
Joseph Loscalzo, M.D., Ph.D.
Department of Medicine, Brigham and Women’s Hospital, and Harvard Medical School
DOI: 10.1056/NEJMcibr1402199