STING como posible estrategia terapéutica para la ELA
Las múltiples causas de la ELA no se conocen del todo, pero la mayoría de los pacientes con ELA tienen en común agregados de la proteína TDP-43 en las regiones afectadas del sistema nervioso central. Esta proteína desencadena una vía inflamatoria que puede impulsar la patología de la enfermedad.
Los trastornos neurodegenerativos, entre los que se encuentra la esclerosis lateral amiotrófica (ELA), poseen una neurobiología compleja que, al día de hoy, solo está parcialmente definida. Por ello, no existe un tratamiento eficaz para los pacientes que la padecen. El proceso neurodegenerativo afecta principalmente al sistema motor, con pérdida de las motoneuronas superiores en la corteza motora e inferiores en el tronco cerebral y médula espinal. La debilidad y atrofia muscular progresivas, que acaban afectando también a los músculos respiratorios, limitan la supervivencia a entre 2 y 5 años tras el inicio de la enfermedad.
El desarrollo de tratamientos eficaces para la ELA es especialmente difícil: es un trastorno heterogéneo en cuanto a sus causas, el tejido enfermo no es accesible para su examen directo y los biomarcadores conocidos de la enfermedad no reflejan suficientemente la biología subyacente o la progresión de la misma. Sin embargo, el conocimiento de las causas genéticas y de las proteínas y cascadas de la enfermedad relacionadas con ella no deja de aumentar. A pesar de la diversidad de mecanismos, la mayoría de los pacientes con ELA presentan una mala localización citoplasmática y agregación de la proteína de unión al ADN TAR (TDP-43) en las regiones afectadas del sistema nervioso central. Además, el proceso de neurodegeneración va acompañado de la liberación de citoquinas (un factor de inflamación), aunque los signos de inflamación, como hinchazón y calor, están ausentes. En el contexto de la patología y a efectos de la discusión aquí, la respuesta inflamatoria se define como la síntesis y liberación de interferones de tipo I y otras citoquinas proinflamatorias.
Yu y colegas mostraron recientemente cómo se relacionan estas características comunes de la patología: El TDP-43 desencadena una respuesta inflamatoria consistente en la activación del factor nuclear κβ (NF-κβ) y la señalización de interferones de tipo I (figura 1). Los autores identificaron el sensor inmunológico que impulsa esta respuesta inflamatoria y diseccionaron los diferentes pasos de la vía implicada. Como se informó anteriormente, el TDP-43 citoplasmático entra en las mitocondrias, donde induce la toxicidad mitocondrial y la producción de especies reactivas de oxígeno. Esto da lugar a la liberación de ADN mitocondrial en el citoplasma a través de los poros de transición de permeabilidad mitocondrial. Los investigadores demostraron que el sensor de ADN citosólico guanosín monofosfato cíclico-adenosín monofosfato (cGAMP) sintasa (cGAS) es el vínculo entre el ADN mitocondrial citosólico y la inflamación. La cGAS impulsa la producción del mensajero intracelular cGAMP, activando así el estimulador de los genes del interferón (STING), que impulsa las respuestas génicas inflamatorias mediante la activación de la quinasa 1 de unión a TANK (TBK1), que a su vez fosforila (y por tanto activa) el factor regulador del interferón 3 y inhibidor del factor nuclear potenciador del gel de polipéptido de las cadenas ligeras kappa de las células B activadas, alfa (IκBα). Investigaciones posteriores en ratones mutantes revelaron que la supresión genética o la inhibición farmacológica de STING tenían efectos neuroprotectores.
Es interesante que la respuesta inflamatoria desencadenada por el TDP-43 pueda tener conexiones con varios subtipos genéticos de ELA. La proteína C9orf72, cuyos niveles se sabe que están reducidos en pacientes con una mutación C9orf72, ha demostrado que suprime la inflamación inducida por STING, lo que sugiere que una respuesta inmune exagerada es un mecanismo de la enfermedad que contribuye. Es quizás paradójico que las mutaciones heterocigotas de pérdida de función en TBK1 puedan causar ELA, mientras que se esperaría que una reducción de la inflamación inducida por STING fuera beneficiosa. Alternativamente, las mutaciones en TBK1 podrían causar neurodegeneración al limitar otra función de TBK1, como la regulación de la maduración de los autofagosomas. Es interesante que las mutaciones en OPTN, el gen que codifica la optineurina, una proteína necesaria para la activación de TBK1, también causan ELA.
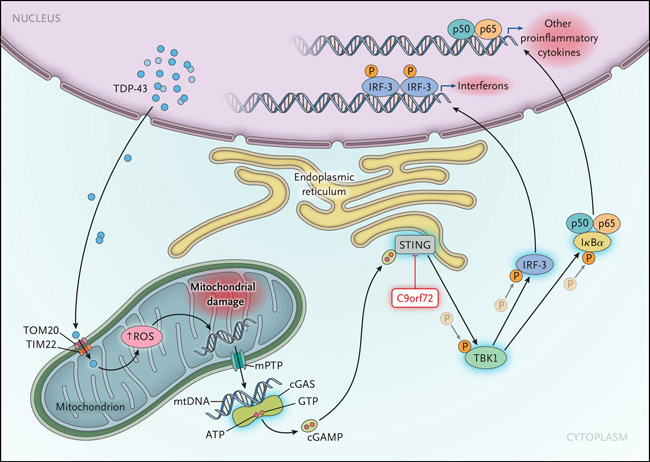
Figura 1. Activación de STING en ELA.
Yu y sus colegas informaron recientemente de pruebas que recalcan la importancia del sensor citoplasmático de ADN guanosín monofosfato cíclico-adenosín monofosfato (cGAMP) sintasa (cGAS) como factor etiológico en la esclerosis lateral amiotrófica (ELA). La proteína 43 de unión al ADN TAR citoplasmática (TDP-43) es transportada a través de las membranas mitocondriales externa e interna por las translocasas TOM20 (translocasa de la membrana mitocondrial externa 20) y TIM22 (translocasa de la membrana mitocondrial interna 22), causando daño mitocondrial a través de la producción de especies reactivas de oxígeno (ROS), lo que resulta en la liberación de ADN mitocondrial. El cGAS desencadena una respuesta inmunitaria innata en la que se libera el sensor de ADN citosólico guanosín monofosfato cíclico-adenosín monofosfato (cGAMP), un estimulador de los genes que codifican interferón, lo que impulsa las respuestas genéticas inflamatorias mediante la activación del estimulador de los genes de interferón (STING), que a su vez activa la quinasa 1 de unión a TANK (TBK1). La fosforilación del factor regulador del interferón 3 (IRF-3) y del inhibidor del factor nuclear potenciador del gel de polipéptido de las cadenas ligeras kappa de las células B activadas, alfa (IκBα), genera entonces la transcripción de los interferones de tipo I y de las citoquinas proinflamatorias. C9orf72 suprime la inflamación inducida por STING. GTP significa guanosina trifosfato, mPTP poro de transición de permeabilidad mitocondrial, mtDNA ADN mitocondrial, P fosforilación y TNF-α factor de necrosis tumoral alfa.
En conjunto, estos hallazgos proporcionan un marco claro para futuras investigaciones. El descubrimiento de la vía inflamatoria desencadenada por TDP-43 ofrece un gran potencial para la intervención terapéutica a diferentes niveles: la inhibición de la entrada de TDP-43 en la mitocondria, de la liberación de ADN mitocondrial, de la respuesta cGAS y de la activación de STING. Algunos de estos inhibidores ya existen, y el silenciamiento de genes de actores importantes con el uso de oligonucleótidos antisentido también está al alcance. Sin embargo, la evidencia de la activación de la inflamación inducida por STING en pacientes con ELA sigue siendo limitada. Es necesario dar varios pasos antes de iniciar los ensayos clínicos. En primer lugar, sería útil estudiar los diferentes pasos de la vía en muestras postmortem de cerebro y médula espinal, y los sistemas de cultivo derivados de células madre pluripotentes inducidas podrían ayudar a evaluar la generalización de los hallazgos y a determinar las contribuciones de los diferentes tipos de células. En segundo lugar, se necesitan herramientas fiables para medir la activación de la vía de STING en pacientes vivos, a fin de proporcionar más pruebas de su relevancia para la ELA y mostrar el compromiso con los blancos de las nuevas intervenciones terapéuticas. Los interferones de tipo I y el factor de necrosis tumoral (TNF)-α pueden analizarse en el líquido cefalorraquídeo y sangre, y trabajos anteriores indican que los niveles de TNF-α están elevados en sangre periférica obtenida de pacientes con ELA. Además, el cGAMP, que se regula por la activación de cGAS al detectar ADN citoplasmático, puede ser un importante biomarcador de esta vía. En conclusión, al identificar a STING como una potencial diana terapéutica, Yu y sus colegas han abierto una nueva y emocionante vía para futuros estudios traslacionales en ELA.
Fuente bibliográfica
STING-Induced Inflammation — A Novel Therapeutic Target in ALS?
Philip Van Damme, M.D., Ph.D., and Wim Robberecht, M.D., Ph.D.
VIB, Center for Brain and Disease Research, Laboratory of Neurobiology (P.V.D.), the Department of Neurosciences, Experimental Neurology, and Leuven Brain Institute, KU Leuven–University of Leuven, and the Department of Neurology, University Hospitals Leuven (P.V.D., W.R.), Leuven, Belgium.
N Engl J Med 2021; 384:765-767