Revertir la atrofia muscular
Dos informes científicos recientes implican a las proteínas sestrinas en la protección contra la atrofia muscular, ocurrida en la vejez y la inactividad, la denervación y los estados catabólicos inflamatorios sistémicos.
Con frecuencia se observa una pérdida importante de proteína muscular (atrofia o emaciación) en la vejez (sarcopenia), en casos de inactividad o denervación muscular y en estados catabólicos inflamatorios sistémicos. La pérdida de masa y función del músculo esquelético tiene consecuencias para la salud mental, social y física, afectando la calidad de vida y aumentando el riesgo de complicaciones adicionales y muerte. Su tratamiento sigue sin respuesta. Al respecto, dos informes sobre el metabolismo del músculo esquelético de Jessica Segalés y colaboradores y Myungjin Kim y colegas proporcionan datos que amplían la comprensión de la dinámica involucrada en el desgaste muscular.
Como la reserva de proteína más grande y lábil del cuerpo, el músculo esquelético adapta constantemente su masa y función a los estímulos fisiológicos y patológicos cuando se alteran las vías de señalización que influyen en el recambio proteico. Aunque se han identificado varias vías que regulan la atrofia muscular (figura 1A), los intentos de detener la señalización atrófica no han podido mitigar clínicamente la enfermedad. Además, la disfunción metabólica mitocondrial es una característica concomitante en la proteólisis muscular patológica. Utilizando transcriptomas, análisis de metabolismo y técnicas genéticas en modelos de moscas y roedores, se han podido distinguir funciones desconocidas de tres proteínas, las sestrinas, en la masa y función muscular. Estas son el producto de tres genes: SESN1, SESN2 y SESN3, que, a la vez, son reguladores metabólicos inducibles por estrés que afectan las funciones antioxidantes y producen beneficios metabólicos al inhibir la señalización de la rapamicina (mTOR) del complejo 1 (mTORC1), que detecta e integra señales nutricionales y ambientales y afecta el crecimiento celular, el metabolismo y la inflamación.
El desgaste muscular, así como la sarcopenia, se produce cuando la actividad de las vías de degradación de proteínas supera a la de las vías sintéticas. La proteólisis se produce principalmente a través de las acciones de las ligasas E3 de ubiquitina (enzimas que marcan las unidades para su degradación). La eliminación de la ubiquitina ligasa en un modelo de ratón fue eficaz para mitigar la atrofia por desuso. Por otro lado, la autofagia (un proceso que elimina los componentes celulares dañados o redundantes, que a menudo se interrumpe en estados patológicos) es un arma de doble filo: el deterioro de la autofagia induce un desgaste muscular profundo en ratones, mientras que la autofagia excesiva también contribuye al desgaste muscular, aumentando la degradación proteica. Dos hormonas endógenas, la insulina y el factor de crecimiento similar a la insulina 1 (IGF-1), pueden frenar la autofagia activando la vía de señalización Akt-mTORC1 y sus efectores posteriores. Además, la estimulación de Akt inhibe la proteólisis mediante la fosforilación de las proteínas del factor de transcripción “Forkhead box O” (FOXO), evitando que entren en el núcleo, donde activan la transcripción de las ligasas E3 de ubiquitina específicas del músculo (figura 1A). Desafortunadamente, la activación de Akt-mTORC1 con insulina exógena o IGF-1 ha mostrado éxito limitado para contrarrestar el desgaste muscular patológico en ratas, en parte porque las células del músculo esquelético se vuelven resistentes a la insulina durante la atrofia. También, la activación persistente de Akt-mTORC1 se ha relacionado con síndromes metabólicos asociados con obesidad, algunos cánceres y disfunción cardíaca.
El ejercicio de resistencia tiene beneficios metabólicos notables (por ejemplo, mejora la sensibilidad a la insulina y disminuye la inflamación) y protege contra hipertrofia muscular, en parte mediante la activación de la proteína quinasa activada por la adenosina 5′ monofosfato (AMPK) y el coactivador 1α del receptor activado gamma del proliferador de peroxisoma (PPARGC1A, también llamado PGC1α), que promueve la función mitocondrial y la biogénesis.
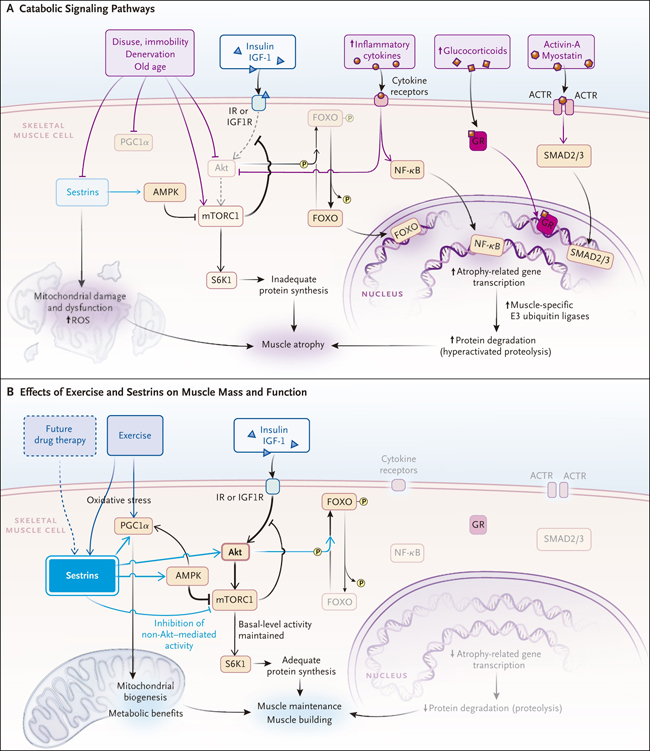
Figura 1: catabolismo y anabolismo en el músculo esquelético
El panel A muestra cómo la insulina y el factor de crecimiento similar a la insulina-1 (IGF-1) afectan el anabolismo de las proteínas mediante la señalización a través de sus receptores (IR y IGF1R, respectivamente). El panel B muestra cómo el ejercicio previene la pérdida de masa muscular y el deterioro funcional.
¿Cómo benefician las sestrinas al músculo? El equipo de Segalés informa que la expresión de sestrina 1 está disminuida en modelos de atrofia muscular (inactividad, denervación o envejecimiento) en concordancia con la activación de proteínas FOXO y, por tanto, con la activación de ligasas E3 de ubiquitina específicas de músculo y procesos proteolíticos. De acuerdo con estos hallazgos la expresión de sestrinas es comparativamente baja en el músculo esquelético de ancianos y personas frágiles. Además, los investigadores encontraron que la eliminación de sestrinas en ratones potenciaba la degradación de la proteína muscular y que su sobreexpresión impedía cambios musculares. Esta protección se asoció con la activación de Akt, la fosforilación de proteínas FOXO y la menor expresión de los genes catabólicos mediados por FOXO. Por lo tanto, se pudo identificar a las sestrinas (sestrina 1 y sestrina 2) como integradoras de las vías anabólicas y catabólicas, y como protectoras del músculo contra la atrofia.
Utilizando modelos de moscas y ratones, M. Kim colegas identificaron a las sestrinas como transductores moleculares de los efectos beneficiosos del ejercicio, incluyendo una mejor resistencia y señalización de la insulina. La inhibición química o la ablación genética de las sestrinas impidió que los organismos adquirieran los beneficios del ejercicio en términos de tiempo e intensidad del ejercicio voluntario o forzado. Por el contrario, la sobreexpresión de sestrina 1 o sestrina 2 fue suficiente para revertir parcialmente el efecto negativo de la inmovilización y la vejez, incluida la pérdida de masa muscular y fuerza (figura 1B).
El pensamiento convencional dice que la activación de mTORC1 mediada por Akt beneficia a los músculos al impulsar las vías de síntesis proteica. Sin embargo, los efectos dependen de los activadores ascendentes (por ejemplo, insulina, aminoácidos y citocinas proinflamatorias), el tiempo (transitorio o persistente) y la magnitud de la activación y el contexto celular. La activación persistente de mTORC1 suprime la actividad de la vía Akt y la autofagia. Estudios previos también han indicado que la activación de mTORC1 que no está acompañada por la activación de Akt promueve la atrofia muscular inducida por la denervación y la sarcopenia, en parte al inhibir la fosforilación de proteínas FOXO mediada por Akt. De acuerdo con estos hallazgos, el trabajo del grupo de Segalés encontró que la expresión de sestrina en la inmovilización y la vejez redujo la hiperactivación de mTORC1 no relacionada con Akt a niveles normales. Este proceso promueve un aumento de la actividad de Akt y la fosforilación de FOXO, lo que a su vez conduce a una disminución de la expresión de los principales atrógenos regulados por FOXO (es decir, genes que codifican enzimas proteolíticas promovedoras de la atrofia muscular) y mitiga el flujo de autofagia mejorando la función y la biogénesis mitocondrial.
El uso del entrenamiento de resistencia para mejorar la función muscular no es una opción viable para muchos pacientes con atrofia muscular o sarcopenia, debido a la apatía relacionada con la enfermedad, la fragilidad, la obesidad mórbida o la capacidad física limitada. Se sabe que hay fármacos para la atrofia muscular eficaces en modelos animales, pero la Administración de Alimentos y Fármacos no ha aprobado ninguno para aplicarlo en la práctica clínica. Ambos grupos de investigación y sus respectivos colegas respaldan un mayor análisis de los inductores o activadores de moléculas pequeñas para atacar a las sestrinas en el músculo como parte de la búsqueda para revertir el desgaste muscular patológico.
Fuente bibliográfica
Muscle Atrophy and the Sestrins
J.A. Jeevendra Martyn, M.D., and Masao Kaneki, M.D., Ph.D.
Department of Anesthesia, Critical Care, and Pain Medicine, Harvard Medical School, Massachusetts General Hospital, and the Research Center, Shriners Hospitals for Children — all in Boston.
N Engl J Med 2020; 383:1279-1282