Neurología
Resolución filamentosa de la neurodegeneración
La enfermedad de Alzheimer es la patología neurodegenerativa más común y no hay terapias basadas en mecanismos para abordarla. Se define por la presencia de abundantes lesiones neurofibrilares y placas neuríticas en la corteza cerebral. Las primeras comprenden filamentos helicoidales y rectos de proteína tau, mientras que filamentos de tau con diferentes morfologías son características de otras anomalías neurodegenerativas. Hasta ahora, no se han determinado las estructuras de filamentos de tau con técnicas que permitan una alta resolución. Sin embargo, recientemente se ha utilizado la microscopía crio-electrónica (crio-EM) y los correspondientes modelos atómicos para determinar la estructura de los filamentos de una persona fallecida a causa del alzhéimer. Tales avances demuestran que la crio-EM permite la caracterización atómica de los filamentos amiloideos a partir de material derivado del paciente, y allana el camino para la investigación de una serie de complicaciones neurodegenerativas.
Proteína tau
A principios del siglo XX, el psiquiatra alemán Alois Alzheimer reportó la presencia de estructuras intracelulares "enredadas" (tangled) en el cerebro de una persona que tenía demencia. Posteriormente los enredos fueron definidos como compuestos anómalos, conocidos como fibrillas amiloides, de la proteína tau (doi: 10.1146/annurev.neuro.24.1.1121). Las fibrillas amiloides de Tau parecen estar en la raíz de docenas de tipos de demencia y trastornos del movimiento relacionados con la edad, sobre todo la enfermedad de Alzheimer. En una reciente publicación, Anthony Fitzpatricket documentaron un paso crucial para la comprensión de las fibrillas amiloides tau, al describir estructuras para los dos tipos de fibrilla vistos en el alzhéimer: helicoidal pareada y filamentos tau rectos.
La proteína tau normal estabiliza los microtúbulos, a lo largo de los cuales la carga celular es transportada en las proyecciones del cerebro. Pero cuando tau es producida en exceso o cuando se desprende de los microtúbulos, se apila formando fibrillas amiloides de varias conformaciones que se propagan de célula en célula. La evidencia sugiere que diversas demencias relacionadas con tau pueden ser el resultado de fibrillas de diferentes conformaciones.
Los investigadores extrajeron las fibrillas amiloides tau del cerebro de una mujer de 74 años que había sido diagnosticada con la enfermedad de Alzheimer 10 años antes de su muerte. Ellos visualizaron las fibrillas usando una técnica llamada microscopía crioelectrónica (crio-EM, por sus siglas en inglés). De los 441 residuos aminoacídicos de la proteína, 73 residuos que forman el núcleo estable de las fibrillas amiloides tau eran claramente visibles en los mapas de crioEM, mientras que la mayoría de los residuos en los extremos de las proteínas estaban escasamente ordenados para ser vistas.
Estas estructuras a nivel molecular revelan algunas características familiares e inesperadas de las fibrillas amiloides. Los apilamientos de tau en los protofilamentos se ordenan de forma paralela entre sí, como hilos en una sábana. El segmento tau que conforma la parte externa de curvas en forma de C, se empaca firmemente contra el segmento que conforma la parte interna de la curvatura, excluyendo las moléculas de agua para formar un área seca llamada cremallera (steric zipper). La exclusión del agua aporta estabilidad a los filamentos, por lo que se impide su liberación de la célula. Este tipo de interfaz es característico de todos las fibrillas amiloides estudiadas con resolución molecular.
El giro brusco en la punta cerrada del la forma de C tiene un nivel inesperadamente alto de complejidad estructural, más típica de las estructuras que han evolucionado para proporcionar alguna ventaja de supervivencia. Este motivo, llamado hélice β, requiere un patrón preciso de polaridad, apolaridad y residuos de aminoácidos pequeños y grandes (figura 1). La complejidad de su patrón sugiere que podría utilizarse para desarrollar marcadores de diagnóstico para distinguir la enfermedad de Alzheimer de otras patologías asociadas a tau.
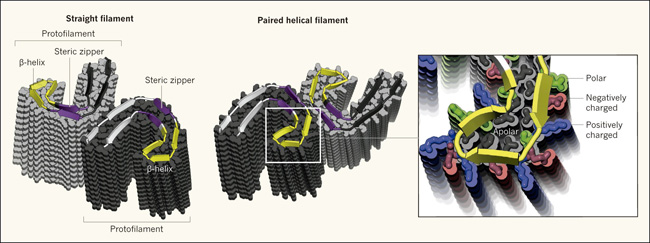
Figura 1. Estructuras de filamentos de la proteína tau.
Los autores muestran dos tipos de agregados anormales: filamentos rectos y helicoidales emparejados, del cerebro de una persona que había tenido la enfermedad de Alzheimer. En ambos casos, las proteínas tau individuales forman una C (la cadena principal de la proteína se indica con una cinta de dibujos con flechas; las cadenas laterales se muestran en gris alrededor de la cinta), que se amontonan para formar protofilamentos. Se muestran 14 capas de proteínas en cada protofilamento. Los filamentos se componen de dos protofilamentos idénticos, conectados en diferentes interfaces. Entre las características notables de los protofilamentos destacan la cremallera estereoscópica (un motivo común en proteínas agregadas, que resiste el desmontaje; morado) y una sorprendente estructura compleja llamada hélice β (amarillos). Esta estructura (amplificada en la figura) requiere que los aminoácidos aparezcan en un patrón preciso de tal manera que las cadenas laterales hidrofílicas (cargadas y polares) se orienten hacia el exterior, mientras que las hidrofóbicas, hacia el interior.
Otra característica sorprendente es la falta de motivos estructurales repetidos. Tau tiene 4 repeticiones imperfectas de una secuencia alrededor de 31 aminoácidos de largo. Los autores mostraron que dos de estos, R3 y R4, se incluyen en el núcleo de las fibrillas. Sin embargo, la similitud estructural entre R3 y R4 se limita a una región corta que abarca sólo ocho residuos. Esta disparidad es un marcado contraste respecto al hallazgo común en biología estructural referido a que secuencias similares adoptan estructuras similares, y da cuenta sobre el desafío de la predicción de la estructura amiloide a partir de solamente datos de secuencias.
Estos dos filamentos de tau son los más largos visualizadas a nivel molecular hasta ahora. Que los filamentos provengan directamente de un cerebro enfermo confirma que la estructura es relevante para la enfermedad de Alzheimer. Quizás, y aún de manera más relevante, las técnicas utilizadas podrían ser aplicadas a otras fibrillas amiloides relacionadas con enfermedades, para las que se han comprobado estructuras de alta calidad igualmente evasivas.
Los autores recolectaron unas 2.000 imágenes de fibrillas con gran aumento usando crio-EM. Las imágenes, que revelan moléculas de tau de muchos ángulos, fueron alineadas computacionalmente y promediadas para reducir el ruido, permitiendo la reducción de reconstrucción de la estructura fibrilar. También potenciaron la definición mediante el desarrollo de un software, lo que representa un importante logro bioinformático para el avance en el conocimiento de un importante enfermedad.
Fuente bibliográfica
Neurodegeneration: Taming tangled tau
David S. Eisenberg & Michael R. Sawaya
Departments of Biological Chemistry and Chemistry & Biochemistry, University of California Los Angeles.
doi:10.1038/nature23094
Temas Relacionados