Productos microbianos contra la inflamación
Actualmente, está bien establecido que la interacción hospedero-microbio es un componente fundamental tanto para la salud como para el desarrollo de los estados patológicos. Un parámetro clave en el mantenimiento de un mutualismo saludable entre los humanos y el microbioma es que los microorganismos ahí presentes son capaces de generar metabolitos únicos que proporcionan nutrientes que intervienen en la regulación del desarrollo inmunológico del hospedero. Dos estudios recientes realizados en modelos animales (ratones) muestran que la microbiota intestinal produce metabolitos derivados del triptófano dietario que regulan la inflamación en el intestino y del sistema nervioso central. Además, estos hallazgos posiblemente serían extensivos a humanos, lo cual podría brindar una excelente oportunidad para la prevención de patologías que afectan al sistema inmunológico.
Catabolismo de triptófano
El microambiente de un tejido determina la composición de la microbiota, y también modula la incorporación de componentes dietarios tales como azúcar, grasas o fibras (que funcionan como fuentes de energía para bacterias) lo cual a su vez puede influir en qué especies de microbios prosperan en el intestino. Por el contrario, las alteraciones en la inmunidad del hospedero, ya sean como resultado de variaciones genéticas o de infecciones, también pueden influir en la microbiota intestinal. Por ejemplo, los ratones que carecen del gen que codifica un receptor de reconocimiento de patrones para el flagelo bacteriano, toll-like receptor 5 (TLR5), tienen una expansión poblacional de bacterias flageladas debido a la incapacidad del sistema inmune de responder a tal estructura.
El triptófano es un aminoácido esencial que se obtiene a través de la dieta. En dos investigaciones recientes se muestra que metabolitos derivados del catabolismo bacteriano del triptófano regulan la inflamación y el desarrollo de la enfermedad a nivel local en el intestino y periféricamente en el sistema nervioso central. En una de ellas (Nat Med. 2016 Jun;22(6):598-605), Lamas y su equipo encontraron que ratones carentes del dominio 9 de reclutamiento de caspasas (CARD9), una proteína implicada en la apoptosis y en la inmunidad antifúngica, eran altamente susceptibles a sufrir colitis (enfermedad inflamatoria del intestino), respaldando estudios previos que identificaban al gen de CARD9 como un elemento clave para la susceptibilidad a esta patología. Los autores demostraron que la susceptibilidad a la colitis puede ser transferida a ratones silvestres libres de gérmenes por la simple transferencia de la microbiota. De esta forma, un defecto genético del hospedero da forma a los constituyentes de la microbiota, los que influyen en el desarrollo de la enfermedad. Un análisis más detallado de la microbiota reveló que estos microbios promotores de enfermedades carecían de bacterias capaces de degradar triptófano en ligandos del receptor de aril hidrocarburos (AHR), como Lactobacillus reuteri y Allobaculum.
La alimentación de ratones con las cepas de Lactobacillus podría revertir la susceptibilidad de los animales deficientes en CARD9 a la colitis. Los autores han reportado que las bacterias podrían catabolizar triptófano en derivados de indol, como ácido indol-3-acetico y otros conocidos como ligandos AHR, lo que lleva a la producción de interleuquina 22 (IL-22), que se sabe que es una citoquina crítica para la salud intestinal. Notablemente, la suplementación con IL-22 en ratones con deficiencia de CARD9 los protege contra la colitits y además normaliza la producción de ligando AHR, destacando las dos de comunicación cruzada entre microbios y el sistema inmunológico. Este fenómeno no parece estar limitados a ratones, ya que los ligandos AHR también eran reducidos en muestras fecales de pacientes con colitis.
Rothhammer y sus colaboradores (Nat Med. 2016 Jun;22(6):586-97) encontraron que los efectos de los metabolitos de triptófano no se limitaron al intestino, sino que podrían también regular la inflamación en el sistema nervioso central (SNC). Los autores realizaron en una primera instancia una secuenciación del ARN de los astrocitos aislados desde ratones. Estas célula son las más abundantes en el SNC, y tienen diferentes funciones que van desde la regulación de la transmisión sináptica a la regulación del metabolismo celular y del sistema inmunitario. Los autores encontraron que los niveles de transcritos asociados con una respuesta interferón de tipo I estaban disminuidos en ratones con autoinmunidad del SNC (un modelo de ratón de esclerosis múltiple) en comparación con ratones de tipo salvaje. De hecho, los niveles de los transcritos se redujeron también en muestras cerebrales de pacientes con esclerosis múltiple en comparación con individuos sin la patología. Los autores también encontraron que la enfermedad empeoraba reduciendo la actividad de la vía IFN en ratones a través de la técnica knock down, disminuyendo la expresión del receptor 1 de interferon (alfa y beta) en los astrocitos. Por otro lado, el tratamiento de cultivos primarios de astrocitos con IFN-β condujo a la activación del factor génico 3 estimulado por interferón, que a su vez dio lugar a la transactivación de AHR. La ablación genética de Ahr, específicamente en astrocitos dio lugar a un empeoramiento de la autoinmunidad en el SNC consistente con lo observado en los estudios utilizando técnicas knock down para Ifnar1.
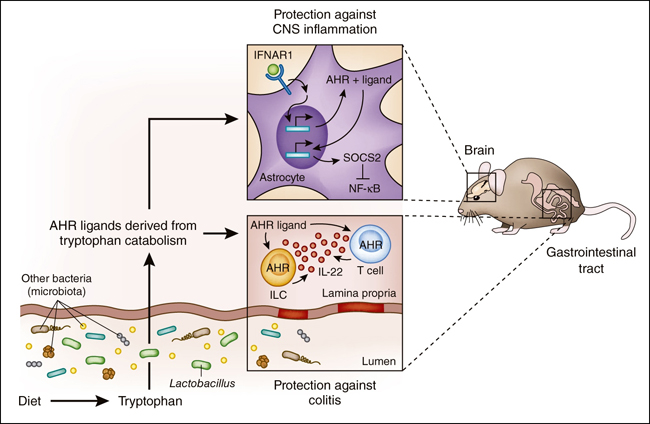
Figura: señalización inducida por metabolitos derivados del triptófano.
El triptófano es un aminoácido esencial que es un componente común de los alimentos proteicos (huevos, pescado, carne y queso). Tras el consumo de tales alimentos, las bacterias intestinales catabolizan el triptófano en una serie de derivados de indol (tales como el ácido indol-3-acético, indoxilo-3-sulfato, el ácido indol-3-propiónico y ácido indol-3-aldehído) que son ligandos para el receptor de aril hidrocarburos (AHR). La activación de AHR en las células T del intestino y en células linfoides innatas (CLI) aumenta la producción de IL-22 (círculos de color naranja), que protege contra la inflamación en el colon (colitis). Los metabolitos de triptófano también tienen efectos sistémicos, y la señalización a través de AHR en astrocitos estimula la vía de señalización regulada por IFN tipo 1, la que culmina en una menor inflamación impulsada por NF-kB (a través de SOCS2) y en una reducción de la autoinmunidad a nivel de SNC.
La activación de AHR fue capaz de inducir la expresión de proteína supresora de la señalización por citocinas-3 (Socs2), lo que limita la activación de NF-kB, un factor de transcripción que impulsa la producción de citoquinas pro-inflamatorias. Por lo tanto, la vía de AHR-Socs2-NF-kB proporciona un mecanismo molecular para el efecto protector de los ligandos de AHR contra la autoinmunidad del SNC. Al igual que en las observaciones de Lamas y colaboradores, el grupo de Rothhammer evidenció que el triptófano tenía un rol regulatorio sobre la respuesta inflamatoria. De hecho, los ratones que fueron alimentados con una dieta libre del aminoácido sufrieron de mayor inflamación del SNC, en comparación con animales con un régimen rico en triptófano, lo cual pudo ser revertido después de la suplementación.
La conversión de triptófano de la dieta en ligandos de AHR es mediada por la microbiota, específicamente por microorganismos sensibles a ampicilina, fenómeno que se observó al tratar ratones con ampicilina y evidenciar una interferencia en la resolución de la enfermedad. En particular, en el estudio de Lamas y colegas L. reuteri también se encontró que era sensible a ampicilina y se sugirió que es un microbio que podría ser relevante para la protección mediada por triptófano contra la inflamación del SNC.
Ambos estudios han tomado caminos distintos para llegar a una conclusión común que pone de relieve un nodo central en el control de la inflamación mediada por AHR. Sus hallazgos aportan más pruebas para apoyar la idea de que el microbioma intestinal no tiene sólo efectos locales, sino también sistémicos (figura 1). Sin embargo, seleccionar uno de los componentes (dieta, microbioma o el sistema inmune) sobre el eje intestino-cerebro como una potencial terapia podría no ser suficiente para superar las enfermedades inflamatorias. Por ejemplo, los ligandos de AHR son potentes inductores de linfocitos T helper 17, de hecho, potencian en lugar de suprimir, la inflamación del SNC en models de ratón. Por otro lado, el triptófano tiene amplios efectos más allá de lo descrito en estos estudios, como por ejemplo la regulación de la serotonina y su uso para el tratamiento de trastornos del sueño y la depresión. Además, el uso de L. reuteri como probiótico para mejorar la vía catabólca del triptófano probablemente sólo será efectivo si estas bacterias se trasplantan en un entorno inmunológicamente permisivo. Además, estas bacterias tendrían que competir con la microbiota residente por el nicho ecológico y por el acceso a su sustrato, el triptófano.
Considerando la heterogeneidad de la población con respecto a la genética, la microbiota y enfermedades, parece que hay al menos dos enfoques terapéuticos que vale la pena investigar. En el nivel más simple, el consumo de una dieta equilibrada es probable que apoye los efectos beneficiosos de la microbiota y sus metabolitos asociados, tales como ligandos de AHR y ácidos grasos, en una amplia gama de individuos. Sin embargo, la medicina personalizada en la que los individuos son "clasificados" en función de su microbiota y metaboloma, y los parámetros clínicos de sus enfermedades, puede que sea necesaria para encontrar un tratamiento adecuado que restaure el equilibrio y la salud.
En general, estas investigaciones hacen importantes contribuciones a la comprensión de algunos de los mecanismos subyacentes al SNC y a enfermedades inflamatorias intestinales, y deberían ayudar directamente a establecer estrategias novedosas para la prevención y tratamiento de estas patologías. A medida que el campo de investigación sobre el microbioma y metaboloma va madurando, se podrán evidenciar, más temprano que tarde, avances significativos en la asistencia sanitaria a personas que sufren enfermedades inflamatorias.
Fuente bibliográfica
Regulating inflammation with microbial metabolites
Benjamin J Marsland
Faculty of Biology and Medicine, University of Lausanne, Service de Pneumologie, Centre Hospitalier Universitaire Vaudois (CHUV), Lausanne, Switzerland.
doi: 10.1038/nm.4117
Temas Relacionados