Presión reguladora de la inmunidad
El reconocimiento directo de patógenos por parte de las células del sistema inmune innato es un factor crítico de la respuesta inflamatoria. Sin embargo, este componente celular también puede sensar su microambiente local y responder a las fluctuaciones fisiológicas de temperatura, pH, oxígeno y disponibilidad de nutrientes, que se alteran durante la inflamación. Aunque las células del sistema inmunológico experimentan fuerza y presión a lo largo de su ciclo vital, se sabe poco acerca de cómo estos procesos mecánicos regulan la respuesta inmunológica. Al respecto, un reciente estudio muestra que la presión hidrostática cíclica, similar a la que experimentan las células inmunitarias en el pulmón, inicia una respuesta inflamatoria a través del canal iónico PIEZO1 el que se activa mecánicamente. En un modelo animal para el estudio de este fenómeno, ratones que carecían de PIEZO1 en sus células mieloides no mostraron características de inflamación pulmonar en el contexto de una infección bacteriana o autoinflamación fibrótica. Tales resultados revelan un eje sensorial ambiental que estimula a las células inmunitarias innatas a montar una respuesta inflamatoria, y demuestran un papel fisiológico para PIEZO1 y la mecanosensibilidad en la inmunidad.
PIEZO1: un canal iónico
Una respuesta inmunitaria eficaz a los signos generales de infección, regulada por la inmunidad innata, es esencial para la eliminación de bacterias no deseadas. Esta respuesta debería finalizar cuando la infección haya terminado, amortiguando y bloqueando cualquier respuesta inflamatoria indeseada. Los procesos que determinan si la inflamación es efectiva o disfuncional son de considerable interés terapéutico, dada la falta de estrategias disponibles para tratar la inflamación dañina a la vez que se preservan las defensas beneficiosas del huésped. Los esfuerzos para comprender cómo responden las células inmunitarias a la inflamación, a su vez, han centrado la atención en los procesos de regulación inmunológica. Estos incluyen los procesos involucrados en la detección del daño asociado con la infección, así como los necesarios para reconocer otros cambios relacionados con la infección, tales como alteraciones en los niveles de nutrientes o de oxígeno. En una reciente publicación, Solis y colaboradores revelaron que las señales mecánicas generadas en el pulmón de ratón son detectadas por células inmunitarias y son reguladores cruciales de una respuesta inmunológica (DOI: 10.1038/s41586-019-1485-8).
Las células mieloides del sistema inmunitario -un grupo que incluye macrófagos y monocitos- están expuestas a una serie de fuerzas físicas, por ejemplo, las que se encuentran al dejar que los vasos sanguíneos entren en los tejidos. Los ciclos de fuerza mecánica se producen en órganos como los pulmones, en los que los tejidos se comprimen durante la respiración. Estas fuerzas están sujetas a cambios en los estados de la enfermedad, por ejemplo, cuando el tejido se hincha durante una respuesta inflamatoria. Solis y sus colegas informan que los macrófagos y monocitos pueden responder a señales mecánicas que se perciben a través de un canal iónicos mecanosensorial llamado PIEZO1 localizado en su superficie celular.
Para entender si la exposición de las células mieloides a las fuerzas mecánicas podía regular directamente la función de las células inmunitarias, los autores generaron ratones que carecían de PIEZO1 en las células mieloides. Utilizando un sistema in vitro, los autores sometieron a las células inmunitarias a ciclos de cambio de presión, imitando los que se encuentran en el pulmón, denominados presión hidrostática cíclica. Luego compararon macrófagos y monocitos silvestres y deficientes en PIEZO1, lo que reveló que la presión hidrostática cíclica induce un perfil de expresión génica proinflamatoria en células silvestres que dependen de PIEZO1. Este perfil de expresión incluía genes controlados por el factor de transcripción HIF1α, un regulador necesario para que las células mieloides funcionen y sobrevivan. Curiosamente, esta respuesta de expresión génica proinflamatoria no se vio afectada por la magnitud de la presión encontrada.
Para entender los mecanismos que impulsan esta respuesta transcripcional, los autores estudiaron los macrófagos que eran deficientes en HIF1α. Encontraron que las células eran incapaces de montar una respuesta de expresión génica proinflamatoria a la presión hidrostática cíclica. Los autores revelaron que el hecho de someter a las células silvestres a este tipo de presión en el sistema in vitro provoca una afluencia de iones de calcio en las células a través del canal PIEZO1, lo que resulta en la acumulación de HIF1α (figura 1). Este impulso a HIF1α mediado por PIEZO1 requirió la producción de la hormona endotelina 1, que actúa en una vía de señalización que estabiliza HIF1α en las células. La endotelina 1 es secretada por las células y actúa uniéndose a su receptor ya sea en forma auto o paracrina.
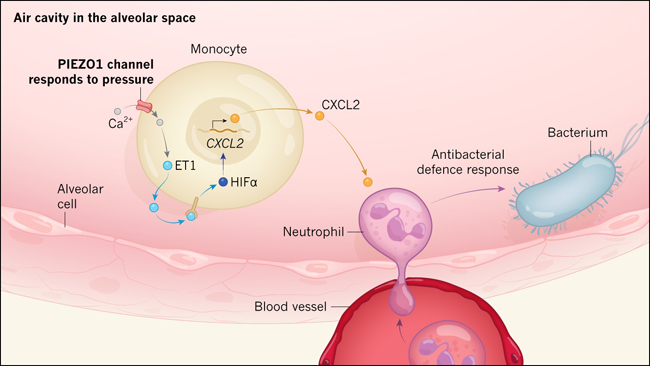
Figura 1. Las células inmunitarias del pulmón responden a la presión activando una respuesta defensiva.
Mediante el estudio in vitro in vitro de células inmunitarias de ratones y de los modelos de infección bacteriana en pulmones, Solis y sus colaboradores investigaron cómo los monocitos responden a los ciclos de presión que se producen durante la respiración. Se centraron en alvéolos, que son los "sacos de aire" de este órgano. Los autores informan que la presión activa una proteína del receptor mecanosensorial llamada PIEZO1 en los monocitos, desencadenando una afluencia de iones de calcio (Ca2+). Esto conduce a la expresión de la hormona endotelina 1 (ET1), que es secretada por la célula. Cuando se une a su receptor, estimula una vía de señalización que estabiliza la proteína HIFα, que impulsa la expresión de genes proinflamatorios. Uno de estos genes codifica la proteína CXCL2, que es secretada por la célula. CXCL2 atrae un tipo de célula inmune llamada neutrófilo, que entra en el pulmón desde el torrente sanguíneo, con lo cual puede dirigirse a las bacterias presentes.
Para probar el papel de la señalización mediada por PIEZO1 en las defensas del huésped, Solis y sus colegas utilizaron un modelo de neumonía en ratón en el que la infección es causada por la bacteria Pseudomonas aeruginosa. En comparación con los ratones salvajes, los animales que fueron diseñados para carecer de PIEZO1 en las células mieloides tenían menos neutrófilos en los tejidos pulmonares, y niveles más bajos de moléculas proinflamatorias de señalización inmunitaria en los pulmones, como la endotelina 1. También tenían niveles más bajos de la proteína CXCL2, que atrae a los neutrófilos. Estos ratones tenían niveles más altos de bacterias en sus pulmones y una mayor diseminación bacteriana al hígado en comparación con los ratones de tipo silvestre.
Los autores informan que la producción de endotelina 1 no se vio afectada si PIEZO1 se agotaba en macrófagos de ratón que se encuentran en alvéolos, o si el canal iónico se depletaba en las células dendríticas, que son otro tipo de células inmunitarias pulmonares. Sin embargo, el agotamiento de los monocitos causó una reducción en los niveles de endotelina 1, implicando a las células como fuente de esta hormona. Los autores confirmaron que la producción de endotelina 1 dependiente de PIEZO1 tiene un papel clave en las defensas contra la infección, al demostrar que la administración de endotelina 1 a ratones que carecen de PIEZO1 en las células mieloides reduce la carga de bacterias no deseadas, en comparación con la carga bacteriana en animales que no recibieron endotelina 1. El trabajo de Solis y sus colegas es consistente con un modelo en el que la mecanosensación mediada por monocitos en el pulmón activa estas células para producir endotelina 1, impulsando un aumento en el nivel de HIF1α y un perfil proinflamatorio de expresión génica. A su vez, esto resulta en el reclutamiento de neutrófilos, que ayudan a eliminar las bacterias no deseadas.
Estas observaciones plantean cuestiones clave sobre la relevancia de la señalización de PIEZO1 en otras enfermedades asociadas con la alteración de la mecánica pulmonar, como la fibrosis pulmonar. Esta condición se caracteriza por altos niveles de células inmunes en los pulmones, una reducción en la elasticidad pulmonar y un flujo de aire restringido. Solis y sus colegas informan que los ratones que carecen de PIEZO1 en las células mieloides están protegidos del daño pulmonar en un modelo de ratón de fibrosis pulmonar, lo que sugiere que la función de las células inmunitarias reguladas por PIEZO1 podría tener un papel en la enfermedad humana. Esta debe ser un área de enfoque a medida que estos estudios continúen.
Comprender cómo se integran las señales para mediar una respuesta inmunitaria eficaz requerirá una mayor profundidad de comprensión que la que tenemos ahora. Esto es relevante en este caso porque las células inmunitarias se mueven entre diferentes compartimentos en el pulmón, y por lo tanto están expuestas a una serie de señales ambientales. Aunque PIEZO1 puede promover una respuesta proinflamatoria que impulsa la eliminación de bacterias no deseadas, la pérdida de este canal iónico también puede ser beneficiosa, ya que puede proteger contra la inflamación dañina asociada con el modelo de ratón de la fibrosis pulmonar. La disección de las medidas reguladoras que mantienen una respuesta inmunitaria equilibrada y eficaz será necesaria para explorar las vías terapéuticas para dirigirse a las vías mecanosensoriales durante la inflamación pulmonar.
Fuente bibliográfica
Pressure regulates immune-cell function
Sarah R. Walmsley
Centre for Inflammation Research, Queen’s Medical Research Institute, University of Edinburgh, Edinburgh EH16 4TJ, UK.
DOI: 10.1038/d41586-019-02339-4