Nuevos blancos moleculares contra patologías
Las quimioquinas y sus receptores acoplados a proteína G juegan un papel diverso en las respuestas inmunitarias al controlar la migración, activación y supervivencia celular. También están implicados en el ingreso de particulas virales, el crecimiento tumoral y metástasis, por lo tanto, son blancos importantes para el diseño de fármacos para una amplia gama de enfermedades. A pesar de los significativos esfuerzos de la industria farmacéutica en el desarrollo de medicamentos dirigidos a esos receptores, sólo dos compuestos se encuentran disponibles: maraviroc antagonista de CCR5 para la infección por VIH y plerixafor, antagonista de CXCR4 para la movilización de células madre. Sin embargo aún existe una limitada comprensión del mecanismo de acción de los antagonistas de receptores de quimioquinas y una incapacidad para optimizar los compuestos en ausencia de información estructural.
Receptores celulares
Una familia de proteínas de membrana conocidas como receptores acoplados a proteína G, median un tipo de comunicación celular basada en la transducción de señales transmembrana. Un subconjunto de esta familia, los receptores de quimioquinas, regulan la migración celular y su activación se ha vinculado con una serie de enfermedades,incluyendo trastornos inmunológicos y cáncer. Pero encontrar fármacos que inhiban estos receptores ha sido desafiante. Dos recientes estudios describen las estructuras cristalinas de dos receptores de quimioquinas en complejo con moléculas pequeñas inhibidoras. Estos antagonistas se unen a los bolsillos cercanos a la parte intracelular de los receptores apuntando a un camino no identificado que puede ser el punto de partida para el descubrimiento de un nuevo medicamento.
La mayoría de las moléculas de fármacos que se dirigen a receptores asociados proteína G (GPCR) imitan la actividad de unión de un activador nativo, potenciando o inhibiendo la señalización del receptor para lograr un efecto terapéutico. Los fármacos normalmente ocupan un bolsillo de denominado sitio ortostérico en la región transmembrana del receptor que es accesible al exterior de la célula. Pero la afinidad con la que los ligandos activadores se unen a receptores puede aumentarse por la unión de proteína G. Este fenómeno, conocido como efecto alostérico, está bien establecido en la farmacología de la GPCR y proporciona una alternativa para el descubrimiento de fármacos.
A diferencia de las proteínas G, que se unen al lado intracelular del receptor, Lado del receptor, otras moléculas alostéricas tienden a unirse a sitios que están dentro la región de la membrana o en la región extracelular, incluso superpuestas al bolsillo ortostérico. Sin embargo, algunos fármacos candidatos y anticuerpos parecen unirse a la región citoplasmática de los GPCR (incluyendo a receptores de quimioquinas) y afectan la función. Hasta ahora, aún no se ha descrito en detalle algún fármaco alostérico que se una a la superficie citoplasmática de un GPCR.
En un primer estudio, Christine Oswald y colaboradores (Nature. 2016 Dec 15;540(7633):462-465) mostraron la estructura cristalina del receptor de quimioquinas CCR9 en complejo con una molécula pequeña llamado vercirnon, que actúa como antagonista frente a la actividad de CCR9 (figura 1a). La inhibición de CCR9 es una forma deseable de tratar la enfermedad inflamatoria intestinal, pero vercirnon no ha pasado de estudios de fase III en personas con enfermedad de Crohn. La cristalización del complejo CCR9-vercirnon requiere el uso de una variante de CCR9 con ocho sustituciones de aminoácidos y el truncamiento de los extremos amino y carboxilo, pero los autores confirmaron que ninguno de estos cambios afecta la unión de vercirnon.
La estructura revela los siete segmentos helicoidales transmembrana de CCR9 conectados por tres bucles citoplasmáticos, con una octava hélice que parece descansar sobre la región intracelular de la membrana. Vercirnon posee una estructura asimétrica, con forma de V invertida que se une en un bolsillo que comprende cinco de las siete hélices, y mira se orienta hacia fuera directamente en el citoplasma. Su sitio de unión está a unos 33 ångströms del supuesto bolsillo ortostérico, que se encuentra hacia la superficie extracelular de las siete hélices.
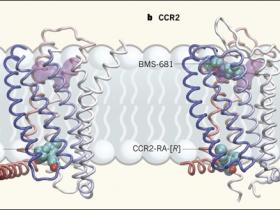
En el segundo estudio (Nature. 2016 Dec 15;540(7633):458-461), Yi Zheng y colaboradores muestran la estructura de CCR2 - que ha vinculado con varias enfermedades inflamatorias y trastornos autoinmunes y en la actividad antitumoral- en complejo simultáneo con dos moléculas pequeñas antagonistas CCR2 - RA- [R] y BMS - 681 (figura 1b). Los autores lograron la cristalización truncando el extremo carboxi-terminal de CCR2, y mediante la fusión de una proteína estabilizante llamada lisozima T4 en un tercer bucle citoplásmico alterado, que es una estrategia común para facilitar la cristalización de GPCR.
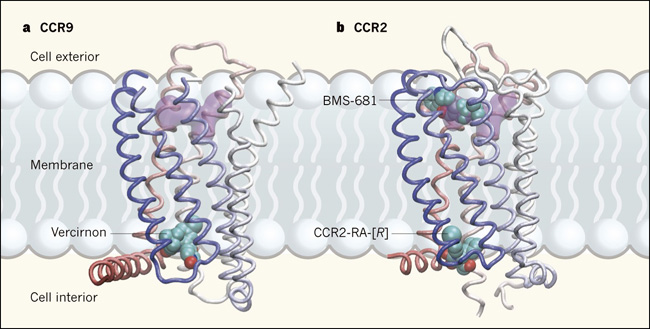
Figura 1: Visualización de la inhibición alostérica.
Dos estudios proveen dan a conocer las estructuras de las proteínas receptoras de quimioquinas en complejo con moléculas pequeñas antagonistas que inhiben la actividad del receptor. En ambas estructuras, el receptor comprende siete dominios helicoidales transmembrana y una octava hélice localizada a lo largo de la región citoplásmica de la membrana (diferentes dominios indicados por el cambio gradual de colores, de azul y blanco a rosado).A, Oswald y sus colegas reportan que la molécula pequeña vercirnon se une en un bolsillo en el lado intracelular del CCR9. El sitio de unión para el fármaco maraviroc en otro receptor de quimioquina, CCR5, se muestra en púrpura para la comparación. B, Zheng y colaboradores muestran la estructura de CCR2 en complejo simultáneo con dos diferentes antagonistas: BMS-681, que se une en un bolsillo que se superpone con el sitio de unión a maraviroc, y CCR2-RA- [R], que se une en un bolsillo intracelular casi idéntico al de CCR9.
BMS-681 se une en un bolsillo que se superpone con el supuesto sitio de unión ortostérico cerca de la superficie extracelular de CCR2, mientras que CCR2-RA- [R] se une en un sitio como el bolsillo alostérico de CCR9. La unión simultánea de los antagonistas provoca que CCR2 adopte una conformación que parece estar completamente inactiva. Aunque vercirnon y CCR2-RA- [R] son diferentes entidades químicas, ocupan sitios de unión que se encuentran en la misma ubicación y poseen un revestimiento tridimensional formado por aminoácidos de las hélices 1, 2, 3, 6 y 7. Estas semejanzas indican que el sitio alostéroco alostérico podría estar presente en receptores de quimioquinas. Si esta suposición es verdadera, se facilitaría el diseño de fármacos que se unan a estos sitios. Vercirnon, por ejemplo, no está optimizado para el bolsillo del CCR9, y es probable que algunas modificaciones menores pudiesen mejorar sus propiedades farmacológicas.
Las estructuras también proporcionan pistas acerca de los mecanismos de antagonismo alostérico intracelular. Los antagonistas unidos previenen el movimiento hacia fuera y la rotación de las hélices (especialmente la hélice 6), que es el sello distintivo de la estructura del estado activo. Particularmente en la estructura CCR9-vercirnon, en la que los loops citoplasmáticos no se modifican para la cristalización y están razonablemente bien resueltos, está claro que vercirnon ocupa un espacio que normalmente se llenaría con el extremo carboxi terminal de una proteína G unida durante la activación del receptor. La unión por la proteína beta - arrestina, que inhibe la señalización y provoca la internalización del receptor, también "chocaría" con la unión de vercirnon.
Sin duda que el progreso en el desarrollo de moléculas pequeñas candidatos a fármacos para los receptores de quimioquinas es un camino lento. Ha habido sólo dos éxitos: el fármaco maraviroc, que media la inhibición de CCR5 para prevenir el ingreso del VIH-1 a las células y plerixafor, que apunta a CXCR4 para movilizar las células madre de la médula ósea para trasplantes en personas con cáncer. Otra docena de receptores de quimioquinas son objetivos para el desarrollo de fármacos para enfermedades que van desde trastornos autoinmunitarios hasta las metástasis del cáncer. El sitio intracelular identificado en los estudios actuales podría proporcionar una nueva estrategia para inhibir estos receptores, convirtiendo el descubrimiento de nuevos fármacos en un esfuerzo realizado de adentro hacia afuera de la célula.
Fuente bibliográfica
Pharmacology: Inside-out receptor inhibition
Thomas P. Sakmar & Thomas Huber
Laboratory of Chemical Biology and Signal Transduction, The Rockefeller University, New York, New York 10065, USA.
doi:10.1038/nature20486