Nuevo enfoque para la recuperación de las fracturas
Estudios previos han mostrado que la formación de tejido óseo durante la reparación de una fractura se inicia con la acumulación de fibrina dentro o alrededor de depósitos extravasculares. La fibrina, por este motivo se ha definido como un componente clave para la reparación ósea permitiendo a moléculas pro-inflamatorias y células progenitoras mesenquimales ingresar al sitio lesionado. Sin embargo, nuevos experimentos han permitido cuestionar cual es la contribución, ya sea favorable o perjudicial de la fibrina para la reparación de fracturas de este tipo. Experimentos recientes con ratones deficientes en fibrinógeno, precursor de la fibrina, así como de plasminógeno, mostraron que la fibrina es totalmente prescindible para la reparación de fracturas óseas, como el fémur. En este sentido, la reducción de fibrina en ratones incapaces de sintetizar plasminógeno mostró una recuperación del tejido óseo, demostrando que la eliminación de fibrina residual es esencial para el crecimiento de tejido vascular y su penetración en el callo de cartílago. Nuevos enfoques que involucren al sistema fibrinolítico y que apunten a reducir la fibrina podrían conducir a nuevas terapias que permitan la regeneración ósea en pacientes de riesgo.
Fibrinólisis
El esqueleto es uno de los tejidos corporales más comúnmente lesionados. Cada año, se producen unas 16 millones de fracturas de huesos largos en Estados Unidos. Afortunadamente, el hueso tiene un excelente potencial regenerativo, y la mayoría se cura de manera eficiente durante un período de 6 a 12 semanas, con la restauración de la integridad del esqueleto y locomoción. Sin embargo, la tasa de recuperación incompleta o retrasada de las fracturas comunes, tales como rotura de la diáfisis femoral, varía de 0 a 15%. Si no se unen los fragmentos separados en un solo segmento estable de hueso, esto resulta en dolor, debilidad, y movilidad reducida. Esas complicaciones son más frecuentes en pacientes de edad avanzada, en quienes el fracaso de una recuperación a menudo resulta en serios compromisos del estado de salud general.
Aunque la fibrosis y la formación de cicatrices son componentes de la regeneración normal en la mayoría de los tejidos, la curación ósea requiere la síntesis de novo del tejido. Esta se produce de una manera análoga al proceso que ocurre durante el desarrollo embrionario y consiste en dos mecanismos interrelacionados - osificación intramembranosa y osificación endocondral (fig. 1).
En la osificación intramembranosa, células mesenquimales progenitoras en las inmediaciones de la lesión se diferencian en osteoblastos, que luego directamente forman el hueso. En la osificación endocondral, las mismas células progenitoras se diferencian a su vez en condrocitos, formando inicialmente un cartílago intermediario que se reemplaza una vez que el hueso se regenera. En este proceso, los condrocitos sufren un proceso de maduración que implica la formación de un templado cartilaginoso calcificado que sirve como un andamio para la formación primaria del hueso. Los condrocitos terminales diferenciados sufren apoptosis y secretan factores (por ejemplo, factor de crecimiento endotelial vascular [VEGF]) que estimulan la formación de canales vasculares que invaden el cartílago calcificado. El tejido óseo primario se forma cuando los pericitos - células progenitoras mesenquimales asociadas a la vasculatura - se diferencian en osteoblastos, los que subsecuentemente forman el tejido óseo sobre el templado de cartílago calcificado y, finalmente, reemplazan el tejido del cartílago.
La osificación intramembranosa y endocondral ocurren simultáneamente y están tanto temporal como espacialmente organizadas dentro del callo de la fractura. La primera, ocurre tempranamente a lo largo de la superficie del hueso en las regiones periféricas proximal y distal respecto al sitio de la lesión. En contraste, la osificación endocondral se produce centralmente, sobrepuesta al sitio de la fractura. Esta última sana cuando el nuevo hueso atraviesa la brecha de la fractura y une los fragmentos previamente separados en un segmento continuo. Dada la importancia de la integridad del esqueleto para la supervivencia de los vertebrados, este proceso de curación inicial se produce rápidamente y el hueso incipientemente formado es desorganizado. Con el tiempo, la fractura es remodelada a medida que se sustituye la matriz ósea desorganizada por una más organizada y biomecánicamente superior. Al término de la curación, la forma del hueso nuevo es similar a la del hueso original.
La recuperación de la fractura depende del reclutamiento, proliferación, acumulación y diferenciación subsecuente de las células progenitoras mesenquimales en el sitio lesionado. La interrupción de cualquier componente de la compleja serie de eventos regulatorios a nivel celular, molecular y tisular, puede conducir a problemas de cicatrización. En una serie de experimentos genéticos con ratones (J Clin Invest. 2015 Aug 3; 125(8):3117-31), Yuasa y colaboradores, encontraron que la fibrinólisis es una paso requerido para la curación normal de una fractura fémur. Al igual que otras lesiones, las fracturas resultan en hemorragias y en la iniciación de la cascada de coagulación, seguidas por la deposición de una matriz de fibrina. Una hipótesis ha sugerido que el coágulo de fibrina, o "hematoma de la fractura," estimula la respuesta inflamatoria local y que es necesario para el reclutamiento de células progenitoras mesenquimales y para la iniciación de la recuperación. Sin embargo, los resultados reportados por Yuasa y equipo, no apoyan esta hipótesis. En su estudio, la curación normal de fracturas ocurrió en ratones incapaces de sintetizar fibrinógeno.
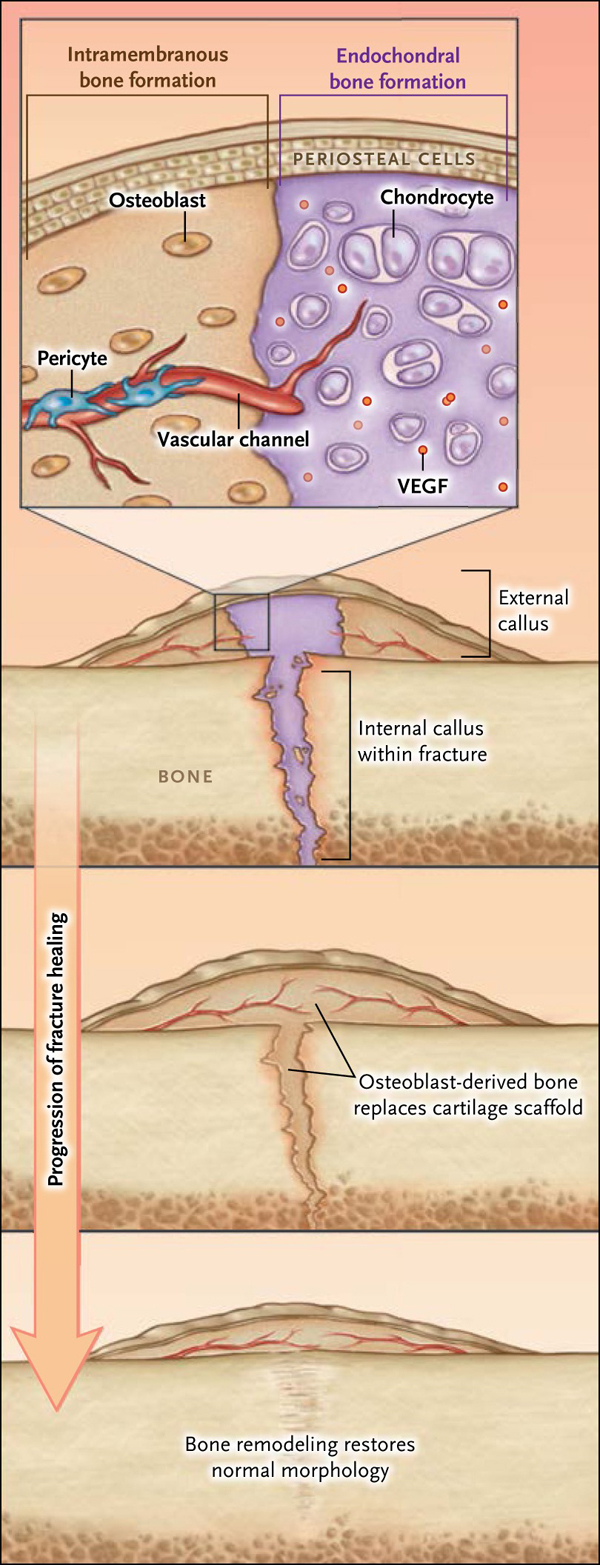
Figura 1: osificación intramembranosa y endocondral durante la recuperación de fracturas
A lo largo de la superficie del hueso en sitios que flanquean la fractura, células progenitoras mesenquimales del periostio se diferencian a osteoblastos y forman el hueso directamente. En la región central de la fractura, estas unidades se acumulan y en un principio se diferencian en condrocitos. A medida que estos maduran, el factor de crecimiento endotelial vascular (VEGF) y otros factores angiogénicos se expresan, la matriz se calcifica y es invadida por canales vasculares. Las células progenitoras derivadas de vasos sanguíneos se diferencian posteriormente en osteoblastos y forman el hueso sobre el templado del cartílago. La recuperación funcional ocurre cuando el tejido del callo calcificado llena el lugar de la fractura y une los fragmentos óseos. El proceso se completa cuando ocurre el remodelamiento mediado por osteoclastos, reemplazando al hueso inmaduro y la morfología de este tejido vuelve a su estado normal.
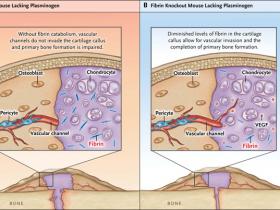
La fibrina se degrada por el plasminógeno. Para determinar si el catabolismo de la fibrina es necesario para la reparación normal de las fracturas, la investigación de Yuasa generó ratones que no producen plasminógeno. En animales de tipo salvaje, la fibrina es catabolizada y está completamente ausente en el cartílago calcificado en el inicio de la invasión vascular, en la formación de tejido óseo primario y en la remodelación de tejidos. Sin embargo, en los ratones sin plasminógeno, la fibrina residual permanece dentro de la matriz del cartílago. En estos ratones, el tamaño del callo fue normal y condrocitos hipertróficos secretaron VEGF, pero los investigadores no observaron invasión vascular en los vasos calcificados del cartílago. Por otro lado, los vasos eran abundantes en el componente óseo intramembranoso de la fractura, pero no se observaron vasos extendidos más allá de la unión entre el hueso intramembranoso y el callo del cartílago calcificado (fig. 2). En ausencia de crecimiento vascular, la formación primaria de hueso en la superficie del templado calcificado de cartílago y la remodelación posterior se vieron deterioradas. Así, mientras que en los ratones silvestres, el sitio de fractura se había curado y remodelado dentro de 42 días, en los ratones que carecen de plasminógeno, se mantuvo un gran callo de cartílago y un sitio de fractura separado. Para determinar si esos resultados fueron causados por eventos más allá del deterioro del catabolismo de la fibrina (la plasmina tiene efectos biológicos que son independientes del catabolismo de la fibrina), los autores eliminaron la expresión de fibrina en ratones deficientes en plasminógeno. Cuando estos fueron tratados con ARN interferentes pequeños antifibrinolíticos, redujeron los niveles de fibrina en la matriz del cartílago y mejoraron la recuperación de la fractura (fig. 2).
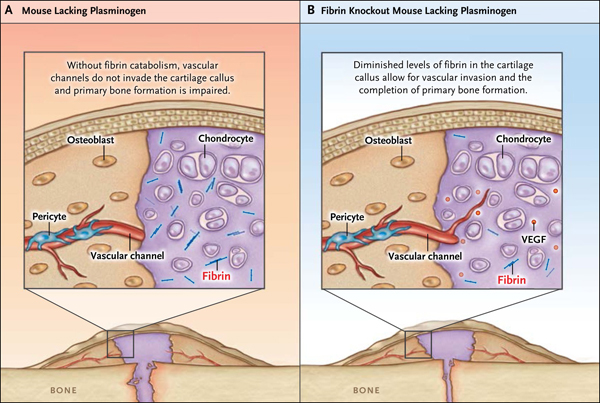
Figura 2: deterioro de la recuperación de fracturas en ratones deficientes de plasminógeno
En ratones deficientes en plasminógeno, la fibrina permanece en el callo del cartílago (panel A). Aunque los canales vasculares se extienden en el hueso intramembranoso, alcanzando la unión del callo del cartílago calcificado, los vasos no pueden invadir el tejido del callo. La ausencia resultante de la formación ósea primaria en el templado del callo del cartílago deteriora la posterior recuperación. En contraste, en ratones deficientes en plasminógeno, cuya capacidad de expresar la fibrina ha sido inhibida, se encuentra una reducción de los niveles de fibrina en el callo del cartílago. Los canales vasculares son capaces de invadir el callo, el tejido óseo primario se forma sobre el templado del cartílago y la recuperación de fracturas procede a terminarse.
Mientras que experimentos genéticos muestran claramente que la formación de un coágulo de fibrina en el sitio de una fractura no es necesaria para la recuperación normal, los autores establecieron que la eliminación de fibrina es esencial para el crecimiento de tejido vascular y su penetración en el callo de cartílago. La matriz del cartílago que contiene fibrina, falla en la formación de hueso primario y su remodelación, perjudicando la recuperación de las fracturas. Debido a que las alteraciones en la fibrinólisis y de la curación de fracturas se asocian tanto a edades avanzadas, a exposiciones ambientales y a muchas enfermedades crónicas, estos hallazgos deberían estimular más estudios. Sin embargo, preguntas importantes deben ser respondidas antes de que estos puntos de vista puedan traducirse en terapias. ¿Es la fibrina residual un componente del tejido de callo de la fractura que ha fracasado en sanar? ¿Está comprometida la fibrinólisis en una fractura del callo con el hábito de fumar o por obesidad, diabetes, y otros estados crónicos de enfermedades? ¿En los pacientes que tienen tales enfermedades, podrían las intervenciones que mejoran la fibrinólisis promover la curación de fracturas? Las respuestas a estas interrogantes podrían conducir a nuevas terapias que mejorarán la regeneración ósea en pacientes con riesgo relacionado a la recuperación de fracturas.
Fuente bibliográfica
Fibrinolysis as a Target to Enhance Fracture Healing
Regis J. O’Keefe, M.D., Ph.D
Department of Orthopedic Surgery, Washington University School of Medicine, St. Louis.
DOI: 10.1056/NEJMcibr1510090