Mecanismos epigenéticos del cáncer de próstata
La regulación de la expresión génica es fundamental tanto para el desarrollo normal como para la enfermedad. Nueva evidencia proporciona información sobre cómo el aumento de la actividad de los receptores de andrógenos puede "activar el interruptor" de la regulación genética en la glándula prostática, lo que conduce al cáncer de próstata.
Los esfuerzos para traducir los descubrimientos de laboratorio en aplicaciones clínicas y para transformar los problemas médico-oncológicos en preguntas de investigación se han convertido en un desafío especial debido a la historia natural del cáncer de próstata. Para empezar, los programas de detección y diagnóstico temprano mediante pruebas no invasivas (por ejemplo, el análisis del antígeno prostático específico en suero [APE] y del antígeno de cáncer prostático 3) han restringido la cantidad de tejido tumoral disponible para estudios moleculares. Además, y a pesar de la alta incidencia de cáncer de próstata en los hombres, la enfermedad está prácticamente ausente en otros mamíferos (incluidos los primates no humanos en cautiverio), descartando modelos animales naturales. Muchos cánceres de próstata se limitan al órgano cuando se diagnostican y se requiere un seguimiento prolongado (de 10 a 15 años) para detectar ventajas de supervivencia. Dadas las limitaciones prácticas de la obtención del tumor y de la línea de tiempo, es difícil lograr muestras coincidentes de glándula prostática normal (no maligna), del cáncer de próstata confinado a un órgano y de la metástasis ósea para analizar la progresión a nivel molecular con el fin de avanzar en estrategias de tratamiento basadas en los mecanismos.
El cáncer de próstata se da por alteraciones genéticas y epigenéticas interrelacionadas. Los contribuyentes genéticos conocidos son la presencia de variantes genéticas de la línea germinal que aumentan el riesgo y de mutaciones somáticas, reordenamientos o expresión irregular de ARN no codificantes que promueven la tumorigénesis y la metástasis. Un elemento central de sus mecanismos fisiopatológicos es el receptor de andrógenos, un factor de transcripción maestro (proteína que se une al ADN o a la cromatina y que regula la expresión de varios genes) (figura 1). No se sabe bien cómo el epigenoma contribuye a la progresión del tumor. El epigenoma incluye metilación del ADN y modificaciones de las histonas (acetilación o metilación) que reprimen o activan la expresión génica; en algunos casos, dicha actividad perpetúa un estado abierto de la cromatina, que puede preservar el potencial de represión o activación de la expresión génica (se han relacionado los cambios en la estructura de la cromatina que resultan de ciertas mutaciones con el desarrollo de enfermedades).
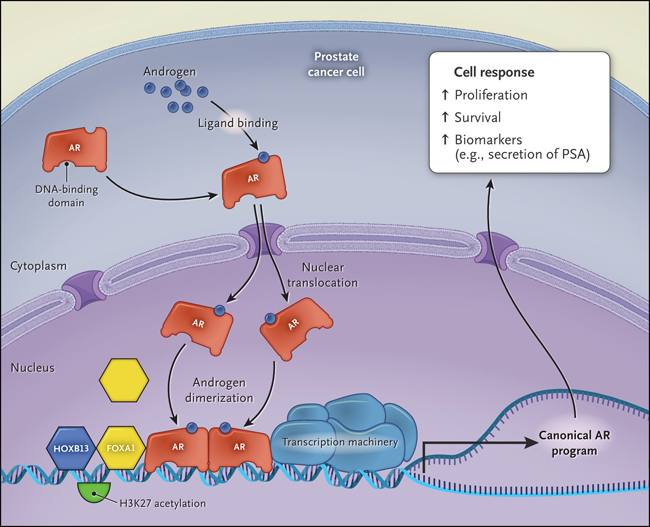
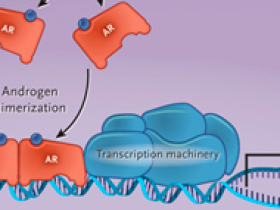
Figura 1: activación y acción del receptor de andrógenos
El receptor de andrógenos (AR) se activa mediante la unión de ligandos de andrógenos, lo que provoca su dimerización, la translocación al núcleo y la activación transcripcional canónico que promueve la supervivencia celular, la proliferación y la secreción de antígeno prostático específico.
En una colaboración binacional holandés-estadounidense, Mark M. Pomerantz y colegas integraron información epigenómica pública de bases de datos de adultos y fetos con un conjunto de datos epigenómicos sobre el epitelio prostático normal, cáncer de próstata localizado y modelos de metástasis de xenoinjertos derivados de pacientes. La información respecto a los modelos de metástasis incluyó patrones de unión del receptor de andrógenos en todo el genoma y dos factores de transcripción adicionales, HOXB13 y FOXA1, que son clave tanto para el desarrollo de la próstata como para el cáncer. También incluyó un sello epigenético de elementos reguladores de genes activos: acetilación de histona H3 en lisina 27 (H3K27ac).
Los investigadores hicieron tres descubrimientos. El primero explica cómo se produce la reprogramación del epigenoma por parte del receptor de andrógenos durante la progresión del cáncer prostático. Los sitios de unión al receptor de andrógenos específicos de metástasis coinciden con la cromatina abierta en el epitelio prostático normal y en el cáncer de próstata localizado. Además, estos sitios preexistentes están premarcados por HOXB13 y FOXA1 (los factores de transcripción ya están presentes en la glándula prostática normal) (figura 2). Presumiblemente, estas proteínas proporcionan acceso directo o indirecto a regiones reguladoras genéticas por el receptor de andrógenos en células tumorales metastásicas. La presencia de estos indicadores en el tejido prostático normal presenta un punto de entrada potencial para la intervención de investigación.
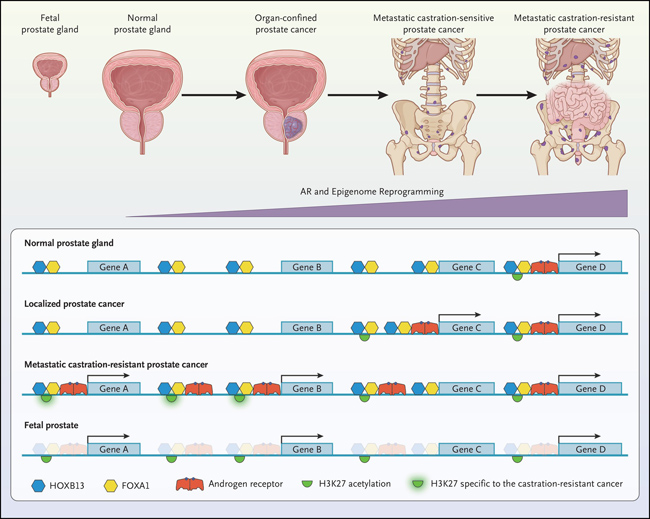
Figura 2: regresión epigenética con progresión clínica del cáncer de próstata
Aquí describen patrones epigenómicos que ocurren en las transiciones de la glándula prostática humana normal al cáncer de próstata confinado al órgano y al cáncer de próstata metastásico resistente a la castración, y los hallazgos con respecto a la metástasis se basan en modelos de xenoinjerto tumoral derivados del paciente. Los sitios de unión del receptor de andrógenos en el genoma se han asociado con esta transición de la glándula prostática normal a la enfermedad metastásica. Dichos sitios de unión están "premarcados" por los factores de transcripción HOXB13 y FOXA1. Además, los sitios que son específicos del cáncer de próstata metastásico resistente a la castración se corresponden con los sitios en el estado de cromatina abierta en la glándula prostática normal y en el cáncer de próstata confinado al órgano, lo que indica una barrera más baja para la reprogramación a un estado metastásico. El patrón del epigenoma (acetilación de H3K27) en la metástasis del cáncer de próstata es similar al de las células prostáticas fetales (pero no adultas). Una limitación del estudio es que no incluye un análisis de células tumorales circulantes o de cánceres de próstata metastásicos sensibles a la castración.
El segundo descubrimiento, quizás más revelador, invoca la teoría propuesta por Conrad H. Waddington, quien acuñó el término epigenética para describir “la rama de la biología que estudia las interacciones causales entre los genes y sus productos que dan origen al fenotipo”. El equipo de Pomerantz se preguntó si las células de cáncer de próstata requieren un nuevo programa epigenético para convertirse en metastásicas o si adoptan un programa existente de su propio repertorio, como una etapa de desarrollo anterior dentro del linaje de la próstata. Varias líneas de evidencia apoyan una conexión entre el estado metastásico y la próstata fetal. En primer lugar, en el análisis de los sitios específicos de metástasis de unión al receptor de andrógenos, se identificaron conjuntos de genes que estaban activos durante el desarrollo del órgano, incluida la vía crítica Wnt. En segundo lugar, se encontró que el patrón del epigenoma (H3K27ac) en la metástasis era distinto al de los epigenomas adultos (incluso en la próstata) y en la metástasis de otros cánceres, pero se parecía mucho al epigenoma de una línea celular derivada de embriones del seno urogenital, una estructura con células destinadas al desarrollo de la próstata. Finalmente, los genes que fueron marcados por H3K27ac en la metástasis de cáncer de próstata humano se expresaban más en tejidos de próstata de ratón embrionario que en la próstata postnatal. Estos datos apoyan la hipótesis de que el epigenoma en las metástasis del cáncer de próstata se asemeja al de un período de desarrollo anterior en el linaje de células prostáticas, cuando las células prostáticas en desarrollo están proliferando y migrando activamente. Con la inclusión de la reprogramación del receptor de andrógenos en el proceso metastásico, esta recapitulación epigenómica puede promover la metástasis de manera plausible, en lugar de ser un reflejo de ella.
El tercer hallazgo es que las secuencias reguladoras genéticas que se identificaron a través del receptor de andrógenos y los patrones H3K27ac en el cáncer de próstata metastásico se superponen sustancialmente con las variantes genéticas de la línea germinal vinculadas a la heredabilidad del cáncer. Quizás estas variantes (o variantes cercanas) afecten la actividad epigenética de los elementos reguladores específicos de la expresión génica de la próstata.
Desde un punto de vista clínico, una deficiencia del trabajo - que puede limitar la precisión de sus modelos de cáncer de próstata - es su dependencia de modelos de xenoinjertos tumorales con tasas de "toma" bajas (los xenoinjertos que se derivan de muestras obtenidas de pacientes con cáncer de próstata son notoriamente difíciles de establecer, con éxito de 10 al 15%, lo que potencialmente introduce sesgos, incluido uno de selección hacia la proliferación de células). Además, el estudio no incluyó algunas fases clave del desarrollo del cáncer de próstata, como el cáncer de próstata recurrente no metastásico (fallo solo del APE) después del tratamiento del tumor primario (que afecta al segundo grupo más grande de pacientes con cáncer de próstata en los Estados Unidos) y el cáncer de próstata metastásico sensible a la castración, otra fase común de la historia natural de la enfermedad. La futura investigación podría incluir más experimentación con muestras de tumores de próstata metastásicos humanos (en lugar de xenoinjertos iniciados por células de cáncer de próstata humano) y el análisis epigenético de las células tumorales circulantes, una vez que el refinamiento de los ensayos unicelulares lo permita. Actualmente, se están utilizando varios moduladores epigenéticos en ensayos clínicos de cáncer de próstata; lamentablemente, ninguno es específico de regiones genómicas o programas epigenómicos. Quizás esta situación cambie, ya que el trabajo de Pomerantz y colegas apoya un enfoque continuo en el epigenoma como objetivo de intervenciones experimentales.
Fuente bibliográfica
Prostate Cancer Progression and the Epigenome
Wadih Arap, M.D., Ph.D., Renata Pasqualini, Ph.D., and Joseph F. Costello, Ph.D.
Rutgers Cancer Institute of New Jersey (W.A., R.P.) and the Division of Hematology–Oncology, Department of Medicine (W.A.), and the Division of Cancer Biology, Department of Radiation Oncology (R.P.), Rutgers New Jersey Medical School, Newark; and the Department of Neurological Surgery, University of California, San Francisco, San Francisco (J.F.C.).
N Engl J Med 2020; 383:2287-2290