Linfocitos que empobrecen la regeneración cerebral
El cerebro de los mamíferos contiene nichos neurogénicos que comprenden células madre neurales y otros tipos celulares. Este microambiente especializado se vuelve menos funcional con la edad, pero no está claro cómo cambia durante el envejecimiento. En una reciente investigación se muestra que en los nichos neurogénicos de ratones longevos existe una disminución de las células madre neuronales activadas, cambios en las células endoteliales y microglia, y una infiltración de linfocitos T. Este tipo celular expresa interferón-γ, y el subconjunto de células madre neurales que tienen una alta respuesta a esta citoquina exhibe una proliferación reducida bajo condiciones in vivo. Esto sugiere que los linfocitos T pueden inhibir la proliferación de células madre neurales en cocultivos, pero también in vivo, en parte mediante por la secreción de IFN-γ. Este estudio revela una interacción entre ambos tipos celulares en cerebros viejos, abriendo vías potenciales para contrarrestar la pérdida de la función cerebral relacionada con la edad.
Interferón gamma
En un adulto sano, las células madre de tejido específico reponen el daño tisular y mantienen la plasticidad (la adición de nuevas células) en los órganos. En dos regiones del cerebro adulto de la mayoría de los mamíferos (la zona subventricular de los ventrículos laterales y el giro dentado del hipocampo), las células madre neurales generan nuevas neuronas, que contribuyen a la plasticidad y cognición cerebral. Sin embargo, todavía existe debate sobre si las nuevas neuronas son generadas comúnmente en el cerebro humano adulto. La proliferación de células madre neurales en mamíferos disminuye con la edad, lo que resulta en una reducción en el número de nuevas neuronas formadas, y el mecanismo subyacente a este cambio es poco conocido. En una reciente investigación publicada en la revista Nature, Ben Dulken y sus colaboradores examinaron cómo los cambios en el microambiente de las células madre neurales en cerebros de ratones viejos afectan la proliferación de células madre (DOI: 10.1038/s41586-019-1362-5).
Las células madre de un cerebro viejo son disfuncionales y tienen menos probabilidades de dividirse que las células troncales jóvenes. Sin embargo, las propiedades intrínsecas de las células madre neurales jóvenes y longevas permanecen estables con un potencial similar para diferenciarse y proliferar in vitro. Las células madre están ubicadas en un microambiente especializado llamado nicho, que consiste en moléculas y otras células con las que interactúan para apoyar su división, supervivencia y función. Los cambios asociados a la edad en el microambiente de este tipo celular no han sido bien caracterizados, por lo tanto, una pregunta aún sin respuesta es si los cambios en este microambiente podrían conducir a una disfunción celular relacionada con la edad.
Dulken y sus colegas investigaron cómo el envejecimiento afecta a diferentes tipos de células en el nicho de células madre neuronales en la zona subventricular del cerebro adulto de ratón. Los autores utilizaron la secuenciación de ARN unicelular para examinar la expresión génica en células individuales de este nicho en ratones jóvenes y viejos. Observaron diferencias en todo el genoma de los animales en los patrones de expresión génica de las células endoteliales y de la microglia y oligodendrocitos.
Los autores también observaron que llinfocitos T CD8+ estaban presentes en cerebros viejos, pero no en los jóvenes (figura 1). El análisis por imágenes reveló que estas células estaban muy cerca de las células madre neurales. Los autores también encontraron que, en los cerebros humanos longevos, las células T se infiltraron en un área equivalente a la región del cerebro del ratón. Estos hallazgos plantean la posibilidad de que estos linfocitos afecten a las células madre que envejecen. Este descubrimiento es intrigante porque un cerebro sano está rodeado por la barrera hematoencefálica, que regula fuertemente lo que puede entrar en el cerebro, y las células inmunitarias del torrente sanguíneo normalmente no cruzan esta barrera.
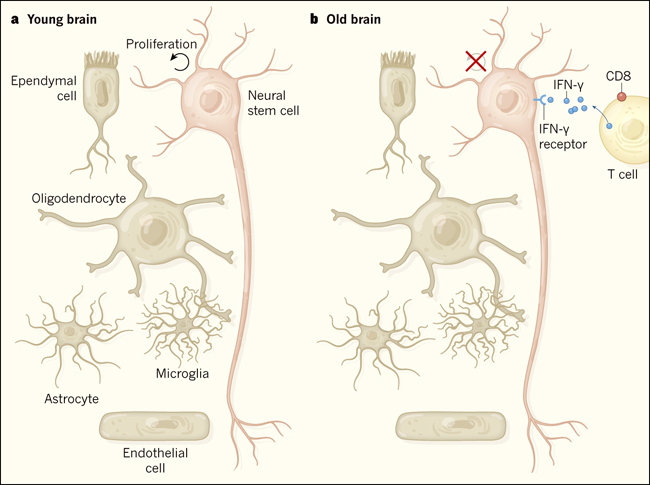
Figura 1. Linfocitos T inhiben la proliferación de células madre neurales en los cerebros viejos.
Dulken y colaboradores estudiaron los cambios en el cerebro de ratones viejos para tratar de entender por qué hay una disminución en la proliferación de células madre neuronales a medida que los animales envejecen. a, En un cerebro de ratón joven y sano, una población de células madre neuronales proliferantes reside en un microambiente especializado llamado un nicho que contiene otros tipos celulares (incluyendo células ependimales, endoteliales, astrocitos, oligodendrocitos y microglia) y moléculas de señalización (no mostradas) que pueden regular la función de las células madre neurales y su proliferación. b, Dulken y sus colegas reportan que, en los cerebros de ratones viejos, los linfocitos T CD8+, se infiltran en el nicho de células madre neuronales. Estos linfocitos secretan interferón-γ (IFN-γ). El receptor de IFN-γ está presente en la superficie de las células madre neurales, y la activación de esta vía inhibe su proliferación.
Los autores encontraron que, en comparación con los linfocitos T en el torrente sanguíneo, los localizados en cerebro de ratones que envejecen producen niveles más altos de interferón γ (IFN-γ). La producción de citoquinas es un sello distintivo de las células T activadas, lo que ocurre cuando reconocen un antígeno. Dulken y sus colegas reportaron que las células madre neurales expresan el receptor de IFN-γ, lo que sugiere que esta citoquina podría ser utilizada para la señalización entre ambos tipos celulares. Cuando se analizó la secuenciación de ARN unicelular, se evidenció que una subpoblación de las antiguas células madre neurales expresaba niveles excepcionalmente altos de genes en respuesta a la señalización de IFN-γ. Cuando los autores monitorearon la capacidad de estas células de alta respuesta para dividirse in vivo, encontraron que las células proliferaban menos que las células madre neurales que tenían una baja respuesta a IFN-γ.
Para probar la hipótesis de que el IFN-γ puede disminuir la proliferación de células madre neurales, Dulken y sus colegas usaron una técnica que permitió a las células T entrar en el cerebro de ratones jóvenes. Esta afluencia fue acompañada por un aumento en la respuesta a IFN-γ por las células madre neurales y una disminución en su proliferación. Los autores también cultivaron estas células obtenidas de ratones jóvenes en presencia o ausencia de linfocitos T. Cuando las citoquinas que inducen la secreción de IFN-γ desde linfocitos T fueron añadidas a estos cultivos, las células madre neurales proliferaron menos que las cultivadas en ausencia de linfocitos T. La alteración de la proliferación en presencia de linfocitos T podría prevenirse con un anticuerpo que bloqueara la señalización del interferón. El trabajo de Dulken y sus colegas es consistente con un modelo que sugiere que el microambiente de las células madre neurales en el cerebro envejecido está infiltrado por linfocitos T que liberan IFN-γ, lo cual es suficiente para inhibir la proliferación de células madre neuronales.
La evidencia de los autores sobre la infiltración de células T en un cerebro envejecido plantea la interrogante de qué mecanismo es el responsable de esta invasión, y si las señales en el cerebro envejecido podrían reclutar linfocitos T. Los estudios futuros deben determinar qué antígenos reconocen las células T infiltrantes. Las que expresan CD4 en el torrente sanguíneo fuera del cerebro tienen un papel en la regulación de la formación de nuevas neuronas en el giro dentado joven a través de un mecanismo desconocido, y sería interesante saber si los linfocitos T CD8 se infiltran en el giro dentado envejecido para inhibir la proliferación de células madre. ¿Podría el bloque de INF-γ en el cerebro envejecido elevar la proliferación de células madre y permitir la generación de nuevas neuronas, y mejorar la cognición? Muchas de estas interrogantes aún quedan por investigar.
El trabajo de Dulken y sus colegas se suma a un creciente conjunto de pruebas que apuntan a las interacciones entre las células inmunitarias y las células madre como causa de la disminución funcional de tejidos relacionada con la edad. Tal vez se puedan desarrollar terapias para dirigirse al sistema inmunológico como una forma de combatir las deficiencias de células madre relacionadas con el envejecimiento en todo el cuerpo.
Fuente bibliográfica
Infiltration of old brains by T cells causes dysfunction of neural stem cells
Allison M. Bond & Hongjun Song
Department of Neuroscience and at the Mahoney Institute for Neurosciences, University of Pennsylvania, Philadelphia, Pennsylvania 19104, USA.
doi: 10.1038/d41586-019-01832-0