Las fuerzas que determinan el destino celular
Mediante el análisis individual de las células progenitoras pancreáticas derivadas de células madre embrionarias humanas se observa que el confinamiento celular es un requisito previo para la especificación endocrina, mientras que la propagación celular conduce a los progenitores hacia una diferenciación ductal. Los estudios mecanicistas identifican la interacción de la matriz extracelular (MEC) con la integrina α5 como la señal extracelular que controla de forma autónoma el destino de los progenitores pancreáticos. Mientras que la señalización MEC - integrina α5 promueve la diferenciación hacia el linaje del conducto, la endocrinogénesis se estimula cuando se interrumpe esta cascada de señalización. Esta misma vía de señalización puede ser inhibida farmacológica o genéticamente para convertir a los progenitores pancreáticos derivados de células madre embrionarias humanas en células de los islotes productoras de hormonas. Tales hallazgos identifican la vía de mecanotransducción intrínseca y extrínseca de las células que controla el destino de los progenitores en el páncreas en desarrollo.
Especialización celular
¿Cómo responden las células a las fuerzas físicas, incluidas las transmitidas por el complejo microambiente celular y extracelular dentro de un tejido? Sabemos que estas fuerzas afectan casi todas las facetas de la biología y función celular, sin embargo, entendemos poco sobre los mecanismos subyacentes. Un estudio realizado recientemente por Mamidi y sus colegas (DOI: 10.1038/s41586-018-0762-2) ayuda a llenar este vacío. Examinaron las células pancreáticas en desarrollo y encontraron que los cambios en el medio extracelular desencadenan una dinámica citoesquelética intracelular y cambios transcripcionales que afectan profundamente la "decisión" de las células de diferenciarse en células endocrinas de los islotes. Mediante la manipulación de las condiciones de cultivo de las células madre embrionarias humanas, así como mediante el uso de enfoques de ganancia y pérdida de función tanto in vivo como in vitro, los autores demostraron que las vías de señalización biomecánicas modulan el destino de las células pancreáticas.
El estudio se basa en la notable observación de que en el centro de los grupos (clusters) celulares - dentro de las cuales las células han sido diseñadas para expresar la proteína verde fluorescente (GFP, por sus siglas en inglés) para reportar la regulación del dominio homeobox pancreático y duodenal 1 (PDX1), un factor de transcripción - se mantiene la expresión de PDX1 mientras que las células que están situadas en la periferia de los clusters pierden su expresión. Diferencias similares en la expresión de PDX1 se han observado desde hace mucho tiempo en el desarrollo de los brotes pancreáticos en ratones y humanos: las células de la región central del páncreas expresan altos niveles de PDX1, que se extingue en las células más periféricas y diferenciadas células acinares. La región central del epitelio pancreático es de gran interés para los investigadores que buscan recrear la ontogenia de las células endocrinas de los islotes en laboratorio y generar células endocrinas de reemplazo para los pacientes diabéticos. Esta parte del epitelio es el "lugar de nacimiento" de las células beta, productoras de insulina, en las que los progenitores pancreáticos protodiferenciados bipotenciales dan lugar a tipos celulares ductales y endocrinas.
Los autores buscaron imitar los estados de confinamiento celular y expansión periférica, similares a los observados en los clusters PDX1-GFP y en el páncreas embrionario. Para lograr esto, utilizaron placas microdiseñadas con pozos de diferentes tamaños para restringir físicamente las células o permitir su propagación. Los autores encontraron que las células cultivadas en pozos estrechos retenían una alta expresión de PDX1, mientras que las células que se dispersaron en pozos más anchos perdieron la expresión de PDX1. Este efecto también se observó en los genes que codifican otros factores que se sabe que regulan el desarrollo endocrino, como NK6 homeobox 1 (NKX6-1) y la neurogenina 3 (NGN3), pero no en los genes "no endocrinos".
Se observó un resultado diferente para el factor de transcripción mecano responsivo YAP1 (yes-associated protein 1). El confinamiento de las células resultó en la pérdida de YAP1. Esta pérdida también ocurre en el páncreas a medida que los progenitores pancreáticos bipotenciales se diferencian en progenitores endocrinos. En efecto, las células endocrinas en proceso de diferenciación no expresan YAP1 en cantidades apreciables. Mamidi y sus colegas observaron un aumento en la diferenciación de los progenitores bipotenciales en células endocrinas al inhibir genética o farmacológicamente YAP1, lo que sugiere que esta proteína normalmente mantiene la bipotencialidad y suprime la diferenciación de los progenitores en células endocrinas. YAP1 activada está presente en el epitelio, por otro lado, suprime la expresión génica endocrina y promueve la expresión del blanco de Notch1, HES1, y la diferenciación en células ductales. Estos resultados identifican un doble papel para YAP1, como supresor de la diferenciación endocrina y como activador de la diferenciación ductal.
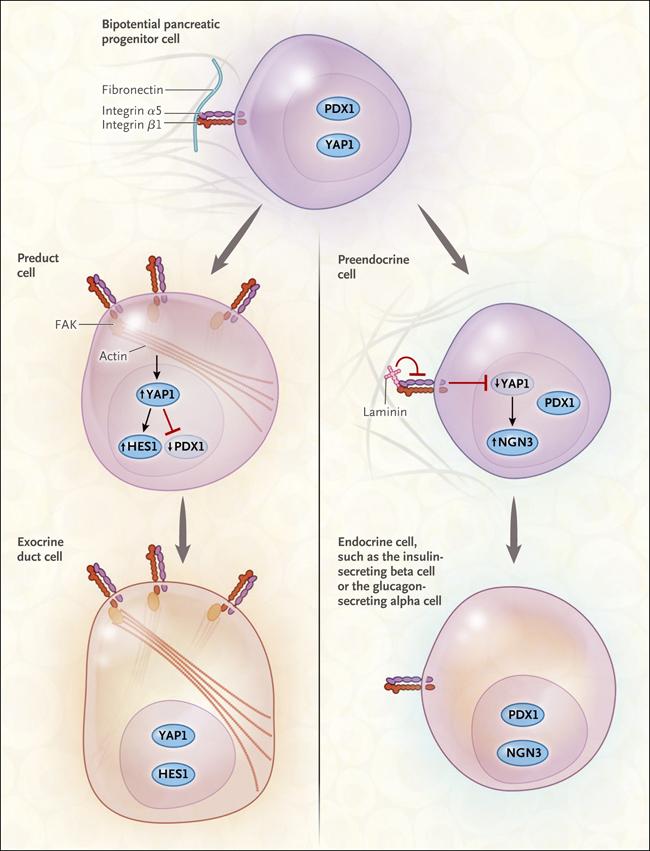
Figura 1. Mecanoseñalización y destino de células progenitoras en el páncreas en desarrollo.
Un estudio realizado por Mamidi y colaboradores (DOI: 10.1038/s41586-018-0762-2) delineó cómo los eventos que influyen en la fijación de la célula preendocrina - específicamente, la señalización de laminina transitoria a través de la integrina α5 - suprimen el factor de transcripción de la proteína YAP1. YAP1, a su vez, normalmente suprime la neurogenina 3 (NGN3), necesaria para la diferenciación de las células progenitoras en células endocrinas. Los altos niveles de señalización de YAP1 en los progenitores ductales promueven la expresión de HES1, un factor de transcripción que promueve la diferenciación en células ductales. Los autores también demostraron que las fibras de "estrés" compuestas de una forma filamentosa específica de la molécula citoesquelética actina, así como la quinasa de adhesión focal (FAK), son necesarias para mantener altos niveles de YAP1 nuclear.
Se plantea entonces la interrogante de qué eventos podrían regular la supresión de YAP1 y la diferenciación endocrina durante el desarrollo pancreático normal. Los autores supusieron que un indicio, como el que surge en el entorno cambiante de la matriz extracelular que rodea al brote pancreático ramificado, puede proporcionar el desencadenante que altera el destino. Los autores encontraron que la señalización de la quinasa de adhesión focal (FAK) es necesaria para la actividad de YAP1 y que una reducción de su vía de señalización promueve la especialización endocrina (figura 1, izquierda). También encontraron que, dentro del corazón del brote pancreático en desarrollo, los niveles de la proteína extracelular laminina 1 aumentaron dramáticamente antes de la explosión de la diferenciación endocrina que ocurrió durante la embriogénesis tardía, conocida como la transición secundaria (figura 1, derecha).
Adicionalmente, demostraron que no sólo la integrina α5 (molécula que se despliega por la membrana celular y se adhiere a la fibronectina de la matriz extracelular) declinaba específicamente en las células aisladas que se estaban diferenciando en células endocrinas, sino que las células ancladas y ricas en laminina podrían inducir este declive. Los autores sugieren que la interrupción de la señalización de fibronectina a integrina, a través de la supresión de laminina por integrina α5, es necesaria para inducir las fuerzas biomecánicas que suprimen YAP1 durante la diferenciación endocrina. También muestran que este efecto es mediado a través del citoesqueleto. Sin embargo, queda por determinar por qué solo ciertas células dentro del grupo de progenitores bipotenciales responden a la laminina 1. Esto podría ser el resultado de una respuesta diferencial debido a los eventos de inhibición lateral que pueden ocurrir en los sistemas epiteliales.
Mamidi y sus colegas han delineado una cascada de eventos moleculares y fuerzas biomecánicas que ocurren dentro de las células a medida que el microambiente de la matriz extracelular circundante evoluciona, actuando juntos como un guardián espacio temporal del destino celular de los progenitores pancreáticos. Han construido un modelo convincente en el que la promoción de la diferenciación en células endocrinas se desencadena por señales extracelulares que suprimen YAP1, que normalmente suprime NGN3. A medida que los investigadores continúan perfeccionando su comprensión de cómo las células beta funcionales se diferencian in vivo, al mismo tiempo están creando una hoja de ruta que se utilizará para recapitular, ya sea in vitro o in vivo, los eventos moleculares que dirigen a las células progenitoras a diferenciarse en células endocrinas de los islotes.
Fuente bibliográfica
Specifying the Pancreatic Islet through Biomechanical Forces
Ondine Cleaver, Ph.D.
Department of Molecular Biology, University of Texas Southwestern Medical Center, Dallas.
NEJMcibr1900052