La ilustre historia de la anemia perniciosa
La anemia perniciosa es una enfermedad crónica causada por una mala absorción de la vitamina B-12 debido a la deficiencia del factor intrínseco (FI) en las secreciones gástricas. Se presenta como una forma adulta relativamente común de anemia que suele asociarse con atrofia gástrica y pérdida de la producción de dicho factor, y como una forma rara autosómica recesiva congénita en la que si bien existe carencia del FI no se observa atrofia gástrica.
Se le consignó este nombre porque era fatal antes de la disponibilidad de tratamiento, primero como terapia de hígado y posteriormente como vitamina B-12 purificada. Hoy, el término "perniciosa" ya no es apropiado, pero se mantiene por razones históricas.
Actualmente, su detección temprana y tratamiento proporcionan un tiempo de vida normal, y por lo general, sin complicaciones. El retraso de la terapia permite la progresión de complicaciones anémicas y neurológicas. Si los pacientes no son tratados tempranamente, los resultados neurológicos adversos pueden llegar a ser permanentes. La anemia grave es capaz de causar también insuficiencia cardíaca congestiva o insuficiencia coronaria.
Vitamina B12 y anemia perniciosa
Encontrar una buena solución o tratamiento que sea eficaz es una trayectoria consagrada a la que muchos estudiantes de medicina, residentes y becarios aspiran. Podría decirse que la finalización más temprana y más célebre de este principio fue la cura de la anemia perniciosa que conduciría al posterior descubrimiento de la vitamina B12 (cobalamina) y su papel fisiológico.
La historia comienza en 1855 con el informe inicial de Thomas Addison de un paciente con semblante pálido, languidez y e indisposición al esfuerzo. En los próximos 30 años, se hizo evidente que muchos individuos con este cuadro clínico tenían dolor, lengua lisa-roja, y entumecimiento digital y hormigueo, que ocasionalmente progresaba a la espasticidad y ataxia. A finales del siglo XIX, los pacientes con estas manifestaciones clínicas padecían atrofia de la mucosa gástrica y ausencia de ácido gástrico así como una anemia caracterizada por grandes eritrocitos ovales. El término "anemia perniciosa" se aplicó en la jerga médica para la designación de los pacientes con esta llamativa constelación de hallazgos clínicos y de laboratorio.
Más adelante, a principios del siglo XX, la anemia perniciosa atrajo la atención de algunos médicos de Boston. En 1908, Richard Cabot informaba que la duración de la supervivencia entre 1.200 pacientes era de 1 a 3 años después de la aparición de la sintomatología. Francis Weld Peabody y George Richards Minot compartieron una profunda apreciación de la importancia de la morfología celular en el diagnóstico y seguimiento del trastorno. Observaciones de Peabody en biopsias de médula ósea de pacientes con la anemia llevaron a la conclusión que la producción de glóbulos rojos era desordenada e ineficaz. George Whipple de la Universidad de Rochester había explorado el efecto de la dieta sobre la regeneración de las células rojas en perros después de la flebotomía periódica. Estos experimentos condujeron a Peabody y Minot a iniciar de forma independiente ensayos dietéticos en tales enfermos.
Minot unió fuerzas con William Murphy en el Hospital Peter Bent Brigham. Los dos eran extraordinariamente detallistas, tanto en la clínica como en el laboratorio. Los resultados de Whipple en perros sugirieron que el hígado debería ser el componente clave del régimen alimenticio. En 1926, Minot y Murphy informaban de sus conclusiones en 45 personas con anemia perniciosa que habían sido tratadas con una "dieta especial" consistente en hígado braseado (casi crudo), junto con carne de res o de cordero y fruta fresca. Al final de la primera semana de tratamiento, un aumento notable en el número de nuevos glóbulos rojos (reticulocitos) estuvo acompañado con una mejora en el bienestar. Dentro de 2 a 4 meses, el recuento de células rojas se elevó a niveles normales en casi todos los individuos que fueron capaces de adherirse a la dieta prescrita. En muchos, se observó una mejoría dramática en las manifestaciones neurológicas. En 1934, el Premio Nobel de Fisiología y Medicina fue otorgado a Minot, Murphy y Whipple "en reconocimiento pos sus descubrimientos de la terapia de hígado en las anemias".
La notable eficacia de este tratamiento en una enfermedad incurable hasta ese momento y generalmente fatal provocó una búsqueda vigorosa del principio activo en el hígado responsable de la cura. En colaboración con Edwin Cohn, un químico de la Facultad de Medicina de Harvard, Minot y Murphy fueron capaces de probar la eficacia de extractos de hígado purificados en la condición megaloblástica. El fraccionamiento bioquímico de estos extractos, junto con el desarrollo de un ensayo microbiológico, finalmente condujo al aislamiento y caracterización parcial de la vitamina B12 en 1948 por Karl Folkers. En 1955, Alexander Todd y Dorothy Hodgkin de la Universidad de Cambridge en Inglaterra colaboraron para resolver la estructura química y tridimensional de la vitamina B12. En 1973, Robert Woodward y su equipo en la Universidad de Harvard lograron la síntesis química de esta molécula. Los últimos tres científicos fueron también ganadores del premio Nobel.
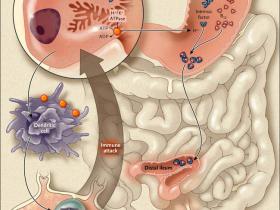
Un año después del descubrimiento de la terapia para la anemia perniciosa, William B. Castle se unió a Minot en el Hospital de la Ciudad de Boston. Plenamente consciente de la presencia casi universal de la gastritis atrófica en la anemia perniciosa, Castle se preguntó si el factor extrínseco hepático que curaba estos pacientes interactuaría con un factor intrínseco normalmente presente en el estómago. Puso a prueba esta hipótesis mediante la aspiración de su propio jugo gástrico después de la ingestión de una hamburguesa y transferirlo hacia el estómago de pacientes con anemia perniciosa. Como se muestra en la figura 1, se observó un aumento rápido de reticulocitos a los 5 días, seguido por un incremento de glóbulos rojos. El momento y la magnitud de esta respuesta hematológica fueron similares al que se lograba con el tratamiento oral de hígado. Luego, demostró que la administración intragástrica de jugo gástrico normal y carne de músculo era efectiva sólo si se daba dentro de un período de 12 horas. Posteriores análisis de Castle y otros investigadores mostraron que el factor intrínseco en el jugo estomacal era una proteína necesaria para la absorción de pequeñas cantidades de vitamina B12 en el intestino delgado distal (fig. 2).
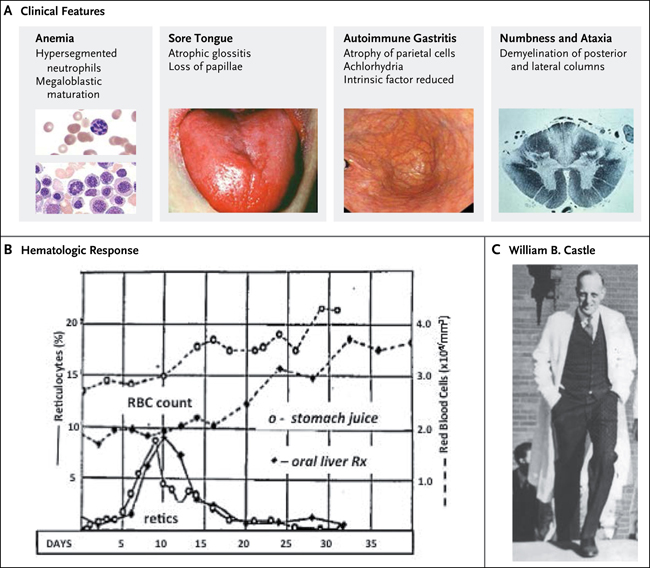
Figura 1: la anemia perniciosa.
El panel A muestra las características clínicas de la anemia perniciosa. El panel B corresponde a respuestas hematológicas en dos pacientes con la enfermedad, según la evaluación de William Castle (Panel C). Un paciente (diamantes negros) recibió tratamiento oral de hígado, y los otros (círculos blancos) una infusión intragástrica de contenidos de uestómago normal de un ser humano después de la ingestión de 300 g de carne de vacuno. Las líneas discontinuas indican los glóbulos rojos (RBC) por milímetro cúbico, y las líneas continuas el porcentaje de reticulocitos (retics).
El descubrimiento del factor intrínseco por Castle no sólo allanó el camino para la comprensión actual, de un modo sutil y elegante, de la absorción de la vitamina B12 en el tracto gastrointestinal, sino que también proporcionó una pista clave en la patogenia autoinmune de la anemia perniciosa. Más del 90% de los pacientes con anemia perniciosa tienen anticuerpos séricos contra células parietales gástricas, y aproximadamente el 50% desarrolla anticuerpos contra el factor intrínseco. Este ataque autoinmune está dirigido por las células dendríticas en el estómago contra las células parietales apoptóticas producidas durante la rotación normal de la mucosa gástrica (fig. 2). Estas unidades dendríticas viajan a los ganglios linfáticos paragástricos, donde activan las células CD4 T que reconocen a la ATPasa intercambiadora de hidrógeno-potasio expresada en células parietales gástricas.
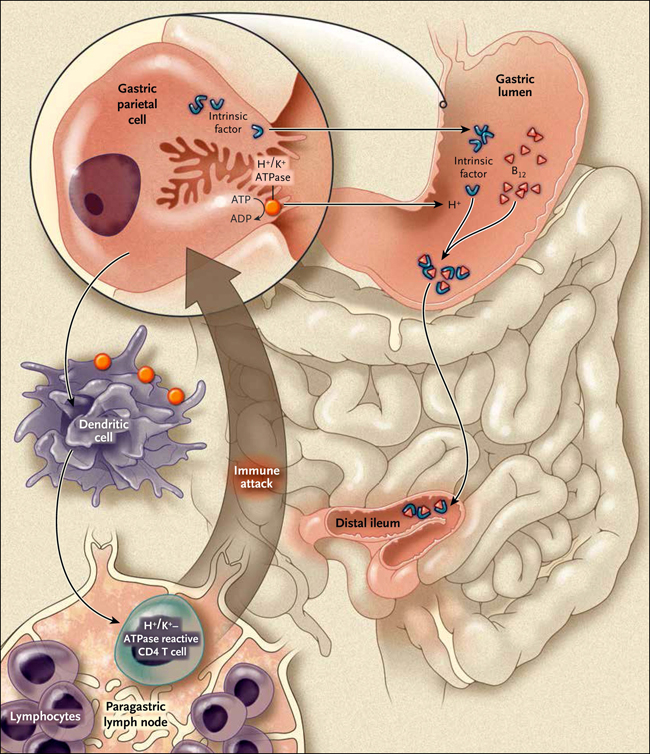
Figura 2: patogénesis de la autoinmune atrófica gastritis en la anemia perniciosa.
El ataque autoinmune es dirigido por células dendríticas en el estómago hacia las células parietales apoptóticas producidas durante la sustitución normal de la mucosa gástrica. Las células dendríticas incluyen ganglios linfáticos paragástricos, donde activan a las células CD4 T que reconocen la ATPasa H+/K+ expresada en las células parietales gástricas.
La anemia perniciosa es sólo una de una serie de enfermedades que se presentan debido a la interacción entre la naturaleza y el desarrollo humano. La distribución de determinados polimorfismos HLA está sesgada fuertemente en personas con gastritis atrófica crónica, así como en la tiroiditis autoinmunitaria. De hecho, la gastritis atrófica está relacionada a la tiroiditis autoinmune, una condición designada como síndrome autoinmune poliglandular tipo 3B. Además, la gastritis atrófica se encuentra a menudo con otros trastornos autoinmunes como la diabetes tipo 1, vitiligo, enfermedad de Addison (insuficiencia suprarrenal primaria crónica) y la enfermedad de Graves (hipertiroidismo).
El medio ambiente parece jugar un papel crucial, y con independencia en la patogénesis de la anemia perniciosa. Una minoría importante de personas con deficiencia de vitamina B12 están infectadas con Helicobacter pylori. Se ha informado que aproximadamente la mitad de estos individuos tiene una remisión hematológica completa y generalmente duradera con solo tratamiento antibacteriano solo.
La ilustre historia de la anemia perniciosa, invita a la especulación. Si el paciente de Thomas Addison con anemia grave habría sido bendecido con la vitamina B12, más tarde hubiese sufrido un mayor riesgo de insuficiencia adrenal de Addison. George Minot era un hombre delgado que tenía diabetes, y fue uno de los primeros pacientes en Boston tratado exitosamente con insulina. Si hubiera vivido una década más, él habría tenido una gran probabilidad de gastritis atrófica autoinmune y anemia perniciosa.
Fuente bibliográfica
Vitamin B12 and Pernicious Anemia — The Dawn of Molecular Medicine
H. Franklin Bunn, M.D.
Division of Hematology, Department of Medicine, Brigham and Women’s Hospital, Boston.
DOI: 10.1056/NEJMcibr1315544