Inhibición enzimática para la leucemia mieloide
La leucemia mieloide aguda (LMA) es un cáncer genéticamente heterogéneo que surge en las células madre hematopoyéticas. Durante los últimos 40 años, el tratamiento estándar para la LMA ha consistido en una combinación de dos agentes quimioterapéuticos, la citarabina y una antraciclina. Este régimen resulta en altas tasas de remisión pero, en la mayoría de los casos, no logra erradicar las células madre leucémicas residuales que son la razón de la recaída y los malos resultados en pacientes con LMA. El análisis genético exhaustivo de la LMA en los últimos 10 años ha revelado genes recurrentes, mutados somáticamente, lo que ha llevado al desarrollo de nuevas terapias dirigidas, incluidos los inhibidores de la tirosina quinasa 3 (FLT3) tipo fms y la isocitrato deshidrogenasa 1 y 2. Sin embargo, la monoterapia con estos fármacos no produce respuestas duraderas, y la combinación con quimioterapia sólo ha mejorado modestamente los resultados. Por lo tanto, se necesitan nuevas dianas farmacológicas para esta patología.
CK1α
En su reciente estudio, Minzel y colaboradores (DOI: 10.1016/j.cell.2018.07.045) sintetizaron inhibidores altamente potentes de la caseína quinasa 1 alfa (CK1α) y los probaron para determinar su actividad en la LMA. CK1α es una serina-treonina quinasa que regula negativamente la señalización de β-catenina y TP53. El hallazgo de que CK1α suprime la actividad de TP53 ha llevado a esfuerzos para desarrollar un inhibidor que, en teoría, debería activar TP53 e inducir la apoptosis. De hecho, la inactivación genética de Csnk1a (que codifica CK1α) en ratones induce una rápida apoptosis en células hematopoyéticas normales y leucémicas que pueden ser suprimidas por la inactivación de Tp53.3 En otro estudio preclínico, se demostró que las células LMA son más sensibles a la inhibición farmacológica que las células hematopoyéticas normales. Recientemente se ha identificado a CK1α como el blanco crítico de la lenalidomida en el síndrome mielodisplásico con deleción del cromosoma 5q (del[5q]). La lenalidomida induce la degradación de CK1α a través de la ubiquitinación - un proceso que dirige las proteínas al proteasoma, que las degrada. Se produce la activación de TP53 y la apoptosis. El efecto terapéutico se debe a la letalidad sintética: el síndrome mielodisplásico con del(5q) es particularmente sensible a la lenalidomida debido a la haploinsuficiencia de CSNK1A1, que se encuentra en el cromosoma 5q.
En la LMA, la lenalidomida como agente único o en combinación con quimioterapia o agentes desmetilantes no logra efectos antileucémicos sostenidos según ensayos clínicos. Esto implica que la ventana terapéutica para la lenalidomida es demasiado estrecha entre las células leucémicas que contienen dos copias de CSNK1A1 y las células hematopoyéticas normales. En las personas con LMA con del(5q), la lenalidomida no es activa, probablemente porque por lo general albergan variantes inactivas de TP53. En conjunto, estos hallazgos sugieren que la degradación de CK1α por lenalidomida no es suficiente para matar las células LMA. Una posible razón para esto puede ser que CK1α active la señalización pro-oncogénica de Wnt/β-catenina y MDM2, que antagoniza con TP53.
Los autores encontraron que los compuestos más activos de su serie inhiben no sólo CK1α sino también la quinasa dependiente de ciclina 7 (CDK7) y CDK9, que son subunidades catalíticas de los factores de transcripción (factor de transcripción IIH [TFIIH] y factor de elongación de la transcripción b[P-TEFb], respectivamente). En las células LMA, la inhibición de CDK7 y CDK9 resultó en una disminución de la regulación transcripcional de varios oncogenes clave. De esta forma, la inactivación de CDK7 y CDK9 contrarrestó algunos de los efectos pro-oncogénicos de la inhibición de CK1α. La inhibición combinada de CK1α, CDK7 y CDK9 fue altamente sinérgica para activar TP53 e inducir la apoptosis en las células LMA (Figura 1).
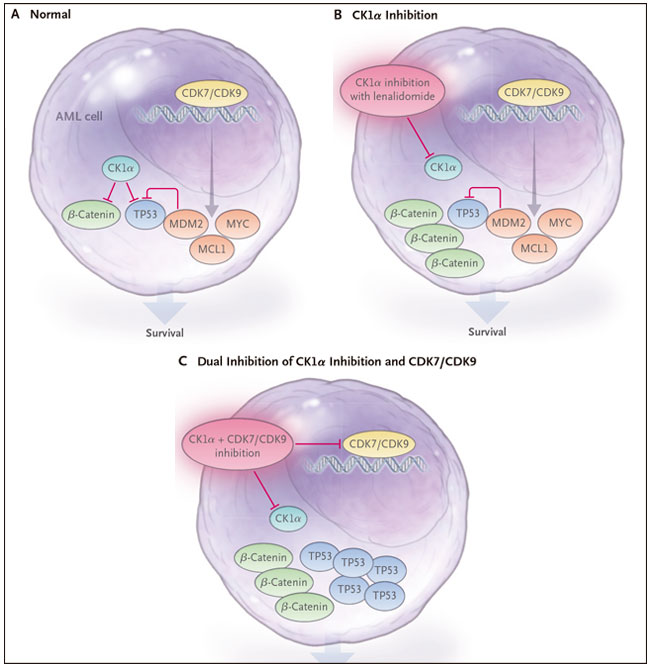
Figura 1. Caseína quinasa 1 alfa (CK1α): un regulador negativo de TP53 y β-Catenina.
La quinasa dependiente de ciclina 7 (CDK7) y CDK9 son subunidades de factores transcripcionales que regulan la expresión de varios oncogenes importantes en la leucemia mieloide aguda (LMA), incluyendo MDM2, MYC y MCL1. Minzel y sus colegas (DOI: 10.1016/j.cell.2018.07.045) reportaron recientemente que el dirigiendose a de CK1α y a CDK7/CDK9 se obtiene una menor transcripción de MDM2, MCL1, y MYC y una fuerte activación de TP53, además generando apoptosis en las células LMA.
Incluso la exposición a corto plazo con inhibidores de CK1α/CDK7/CDK9 durante varios minutos indujo una prolongada disminución de la regulación transcripcional de los oncogenes MYC, MCL1 y MDM2. La administración oral de los inhibidores retrasó la aparición de LMA y erradicó las células madre leucémicas, lo que resultó en la supervivencia a largo plazo en varios modelos de ratones con LMA agresiva y en ratones con xenoinjertos de LMA. Los compuestos eran más activos que la citarabina y el inhibidor de FLT3 midostaurina. La mayoría de los fármacos con actividad antileucémica, incluyendo tanto la quimioterapia convencional como las terapias dirigidas, también afectan a la hematopoyesis normal, que es una de las principales razones por las que estos fármacos fracasan en ensayos clínicos.
Cuando se administran en concentraciones suficientes para matar las células LMA, los inhibidores CK1α/CDK7/CDK9 dañan la hematopoyesis normal sólo moderadamente. Además, los compuestos no tuvieron efectos tóxicos severos en ratones, ratas o perros. Una desventaja potencial de la inhibición de CK1α/CDK7/CDK9 es que este mecanismo depende de una vía intacta de TP53 y por lo tanto se predice que está inactivo en la LMA con mutaciones inactivadoras de TP53 que se pueden encontrar en aproximadamente el 8% de los pacientes con LMA. Por otro lado, este enfoque terapéutico también tiene el potencial de contrarrestar formas de cáncer distintas a la LMA que tienen una vía intacta de TP53.
Fuente bibliográfica
Inhibition of Casein Kinase 1 Alpha in Acute Myeloid Leukemia
Benjamin L. Ebert, M.D., Ph.D., and Jan Krönke, M.D.
Dana–Farber Cancer Institute, Boston (B.L.E.); and the Department of Internal Medicine III, University Hospital Ulm, Ulm, Germany ( J.K.).
DOI: 10.1056/NEJMcibr1811318