Inactivación de CDK12: protectora en el cáncer
El advenimiento de las terapias de bloqueo del punto de control inmunológico que utilizan inhibidores de la proteína muerte programada 1 (PD-1) o de ligando de muerte programada 1 (PD-L1) para el tratamiento de múltiples tipos de cáncer representa un gran paso en la batalla contra el cáncer. El descubrimiento de que ciertos subtipos genéticos de cáncer (en particular aquellos con mutaciones en genes involucrados en la reparación del ADN) pueden ser notablemente sensibles a las terapias de inhibición de PD-1, ha permitido que el estado genómico del tumor brinde información valiosa para apoyar intervenciones. Un descubrimiento relacionado es que los cánceres que tienen mutaciones en genes de reparación del ADN por recombinación homóloga como los codificantes para quinasas dependientes de ciclina (CdK), pueden responder bien al tratamiento con inhibidores de la poli ADP-ribosa polimerasa (PARP) o quimioterapias con platino. En el contexto del cáncer de próstata avanzado, ambas clasificaciones genómicas son clínicamente relevantes. Aproximadamente del 2 al 5% de los cánceres de próstata metastásicos tienen una deficiencia en la reparación de malapareamiento de bases del ADN (mismatch-repair) y del 20 al 30% tienen defectos en la recombinación homóloga, lo que otorga la oportunidad de que los pacientes afectados puedan beneficiarse de los inhibidores del punto de control.
Inhibición de PD1
Recientemente, Yi-Mi Wu y colaboradores (DOI: 10.1016/j.cell.2018.04.034) describieron una nueva subclase molecular de cánceres de próstata avanzados: los definidos por mutaciones somáticas bialélicas de pérdida de función del gen supresor tumoral CDK12, que codifica la proteína quinasa dependiente de ciclina 12 (Figura 1). Anteriormente se pensaba que esta enzima mantenía la reparación del ADN mediante la regulación de los genes de respuesta al daño del ADN (BRCA1, FANCD2 y ATR), y se había sugerido que la enzima estaba asociada con la sensibilidad a los inhibidores de la PARP cuando se inactivaba genéticamente. Wu y sus colegas encontraron la inactivación bialélica de CDK12 en 25 de las 360 muestras de biopsia (6,9%) obtenidas de pacientes con cáncer de próstata metastásico resistente a la castración y en tan sólo 6 de las 498 muestras (1,2%) de individuos con cáncer primario de próstata. En particular, todas las variantes inactivadas de CDK12 eran alteraciones somáticas; no se identificaron mutaciones patógenas de la línea germinal en ningún paciente, lo que sugiere un papel vital para CDK12 en la embriogénesis.
Los autores también descubrieron un papel único para CDK12 en el mantenimiento de la estabilidad genómica. Los genomas de los tumores de cáncer de próstata con inactivación de CDK12 tenían un nuevo patrón de diseminación focal en tándem (es decir, ganancias en el número de copias) de segmentos de ADN que excedían los 8 kb y que estaban dispersos a través de las regiones no codificantes y codificantes, con enriquecimiento en regiones con mayor densidad génica. A diferencia de los cánceres con inestabilidad genómica asociada a deficiencias en la reparación del ADN por recombinación homóloga, los cánceres que tienen variantes de pérdida de función bi alélicas en CDK12 muy rara vez presentan amplificaciones o deleciones grandes (cromosómicas o a nivel del brazo). Además, las mutaciones CDK12 casi nunca se producen junto con variantes patogénicas en genes que codifican proteínas reparadoras del ADN, en genes que codifican proteínas reparadoras por recombinación homóloga (distintas de CDK12), o en otros subtipos genéticos de cáncer de próstata (por ejemplo, aquellos con fusiones de genes de la familia ETS y mutaciones SPOP).
Las duplicaciones focales en tándem que se observaron en los tumores de la variante CDK12 se caracterizaron por una distribución bimodal en la longitud del segmento duplicado - aproximadamente 2,5 Mb o 0,5 Mb, el mismo tamaño que los dominios de replicación del ADN - un hallazgo sorprendente que fue consistente con su ocurrencia como resultado de la re-replicación aberrante del ADN durante la fase S del ciclo celular. Los autores designaron estas reorganizaciones genómicas únicas como duplicaciones focales en tándem asociadas a CDK12.
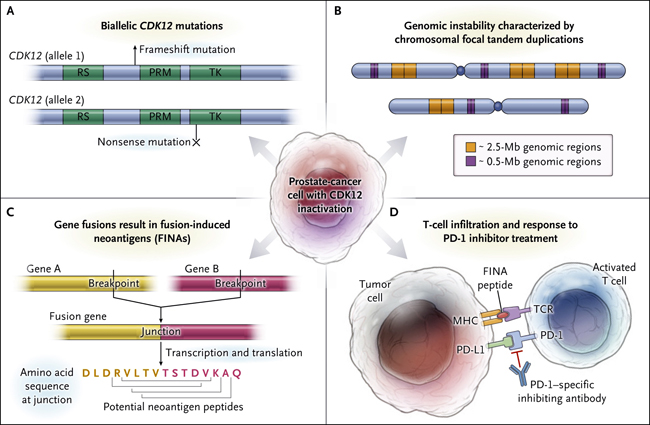
Figura 1. Inhibición de la quinasa dependiente de ciclina 12 y muerte programada 1 (PD-1) - un modelo conceptual.
Wu y colegas (DOI: 10.1016/j.cell.2018.04.034) descubrieron recientemente que las mutaciones bialélicas de pérdida de función en CDK12 causan la inactivación de la proteína quinasa dependiente de ciclina 12 (Panel A), lo que conduce a un patrón único de inestabilidad cromosómica caracterizado por amplias duplicaciones focales en tándem que son de aproximadamente 2,5 Mb o 0,5 Mb de tamaño (Panel B). Estas duplicaciones pueden resultar en fusiones de genes y potenciales neoantígenos inducidos por fusión (FINAs) que son creados por secuencias de aminoácidos quiméricos (Panel C). Estos hallazgos son consistentes con la observación de que los cánceres de próstata que tienen mutaciones en CDK12 a menudo están infiltrados con células T, y también apoyan la hipótesis de que tales pacientes tendrán respuestas favorables a las terapias de bloqueo del punto de control inmunológico (Panel D). MHC denota complejo mayor de histocompatibilidad, PD-L1 ligando 1 de muerte programada, PRM región génica que codifica un motivo rico en prolina, RS región que codifica un motivo de arginina-serina, TCR receptor de células T, y TK región que codifica un dominio de tirosina cinasa.
Luego, en una serie de elegantes experimentos y enfoques bioinformáticos, los investigadores encontraron que los cánceres de próstata de la variante CDK12 estaban enriquecidos con fusiones génicas (resultantes de duplicaciones focales en tándem que ocurren dentro de las regiones codificantes) y que su carga de fusión génica era por lo menos tres veces mayor que la de los cánceres de próstata con reparación por recombinación homóloga deficiente o de la variante ATM. Los autores razonaron que tales fusiones inducirían neoantígenos al crear marcos de lectura abiertos quiméricos que generan proteínas de fusión. Los métodos de predicción de neoantígenos confirmaron un nivel más alto de neoantígenos inducidos por fusión (FINA) en los cánceres de próstata con la variante CDK12 que en todas las otras subclases moleculares del cáncer de próstata. Cuando se examinó la carga total de neoantígenos (que abarca todas las formas de generación de neoantígenos), sólo los cánceres de próstata que eran deficientes en la reparación de mismatch superaron a los cánceres de la variante CDK12, en virtud de su gran número de neoantígenos inducidos por una sola variedad de nucleótidos.
De acuerdo con este hallazgo, los tumores de la variante CDK12 tenían niveles más altos de infiltración de células T y un mayor número de clones de células T expandidas que todos los demás subtipos genómicos de cáncer de próstata (excepto los deficientes en la reparación por mismatch) y también tenían niveles de expresión más altos de ciertas quimiocinas y sus receptores. Finalmente, los datos preliminares de cuatro pacientes con cáncer de próstata avanzado inactivado con CDK12 que fueron tratados con inhibidores de PD-1 sugirieron que dos de estos pacientes tenían disminuciones robustas en el nivel de antígeno específico de la próstata, encogimiento de depósitos metastásicos inducidos por la terapia de bloqueo del punto de control inmunológico, o ambos.
Las implicaciones clínicas del estudio realizado por Wu y sus colegas son profundas e inmediatas. Los ensayos clínicos recientes han demostrado que sólo aproximadamente del 5 al 15% de los pacientes con cáncer de próstata avanzado tienen una respuesta favorable al tratamiento con inhibidores de PD-1, a diferencia de los afectados con otros tipos de cáncer, entre los cuales las tasas de respuesta son más altas. Sin embargo, el descubrimiento de los determinantes genómicos de la sensibilidad de los inhibidores de PD-1 en pacientes con cáncer de próstata sigue siendo difícil. Aunque los cánceres de próstata que son deficientes en la reparación por mismatch pueden representar una subclase que es más sensible a la inhibición del punto de control inmunológico, representan sólo del 2 al 5% de todos los cánceres de próstata resistentes a la castración, lo que significa que la mayoría de las respuestas favorables siguen siendo inexplicables. Si las respuestas tumorales que se observaron en el presente estudio se replican en ensayos clínicos prospectivos, el cáncer de próstata con la variante en CDK12 podría convertirse en el segundo subtipo tumoral genómicamente definido que puede beneficiarse de la terapia anti-PD-1.
Fuente bibliográfica
Cyclin-Dependent Kinase 12, Immunity, and Prostate Cancer
Emmanuel S. Antonarakis, M.D.
Johns Hopkins University Sidney Kimmel Comprehensive Cancer Center, Baltimore.
DOI: 10.1056/NEJMcibr1808772