Hallando el escondite de Staphylococcus aureus
Comúnmente, Staphylococcus aureus es considerado como un patógeno extracelular. Sin embargo, estudios en modelos animales han mostrado que estas bacterias son capaces de evadir el tratamiento antibiótico ingresando al interior de las células. Esto conduce a una colonización a largo plazo y a una infección persistente, causando el fracaso de las terapias, debido a la inaccesibilidad de antibióticos y a su baja actividad intracelular. Recientemente, se logró generar un complejo consistente en un antibiótico conjugado a un anticuerpo, el que recubre la superficie bacteriana y por otro lado, su actividad antimicrobiana es llevada a cabo sólo cuando enzimas proteolíticas intracelulares liberan el antibiótico del complejo. Sorprendentemente, se redujo la carga bacteriana de una forma más eficiente que con antibióticos convencionales, lo cual representa una gran oportunidad para combatir enfermedades infecciosas y contribuir a la disminución de la amenazante resistencia antibiótica.
Reservorios celulares
Staphylococcus aureus, es una bacteria patógena que causa miles de muertes cada año. La terapia es a veces poco exitosa, en parte debido a que genes de resistencia a antibióticos se están extendiendo por todo el mundo. Sin embargo, incluso cepas de S. aureus que carecen de estos genes, a menudo son difíciles de eliminar con los antibióticos disponibles. Se ha sugerido que las bacterias se "ocultan" dentro de las células hospederas. Esta hipótesis se basa en una publicación de Sophie M. Lehar y colaboradores (Nature. 2015 Nov 19;527(7578):323-8), quienes elaboraron un constructo en que un antibiótico está unido a un anticuerpo capaz de unirse a la superficie del patógeno. Por sí solo, este "profármaco" es inactivo, pero cuando las bacterias cubiertas por el medicamento entran a las células hospederas, la actividad enzimática libera al antibiótico. En modelos de ratón de infección por S. aureus, esta estrategia fue notablemente más potente que el tratamiento antibiótico estándar.
Los antibióticos son un pilar de la medicina moderna, pero no son eficaces en todos los casos. Hay por lo menos tres explicaciones para esto. En primer lugar, bacterias patógenas importantes, incluyendo muchas cepas de S. aureus, han adquirido resistencia contra antibióticos convencionales. Segundo, el patógeno puede esconderse en lugares del hospedero que no pueden ser alcanzados por moléculas de antibióticos, o donde las condiciones ambientales, tales como alta acidez, hacen que estos se inactiven. Y tercero, en determinadas circunstancias, las bacterias pueden cambiar a un estilo de vida "persistente" que las vuelve insensible a antibioticos. El cambio a la persistencia todavía no está completamente entendido, pero puede ocurrir en algunos patógenos cuando entran a las células.
En S. aureus, una gama de factores de virulencia manipulan los procesos celulares, inhibiendo eficientemente las respuestas inmunológicas y favoreciendo infecciones en heridas, en el torrente sanguíneo y otros sitios. En ausencia de genes que confieran resistencia, se utilizan varias clases diferentes de antibióticos para tratar infecciones por S. aureus: la rifampicina se emplea a veces para dirigirse a reservorios intracelulares de la bacteria. Sin embargo, estos antibióticos clásicos son a menudo incapaces de curar la infección.
Lehar y sus colegas especularon que este fracaso se debe tanto a una insuficiente accesibilidad y actividad por parte del antibiótico contra la bacteria cuando se encuentra en el interior de la célula. En un intento de superar estos problemas, los investigadores generaron primero un derivado de rifampicina (rifalogue) con propiedades fisicoquímicas alteradas que permitiesen una actividad superior contra células infectadas con S. aureus que han cambiado a un estilo de vida persistente. Posteriormente, identificaron un anticuerpo que se une fuertemente a las estructuras de azúcar que se encuentran en la superficie de todas las cepas analizadas. Entonces, se unieron covalentemente estos dos componentes mediante un enlace químico que se puede romper por enzimas proteasas presentes en sitios intracelulares donde se piensa que la bacteria puede esconderse (fig. 1). Sorprendentemente, en un modelo de infección realizado en ratones, el complejo anticuerpo-antibiótico (CAA) fue mucho más eficaz en la reducción de cargas de patógenos que dos antibióticos convencionales utilizados actualmente para tratar estas infecciones.
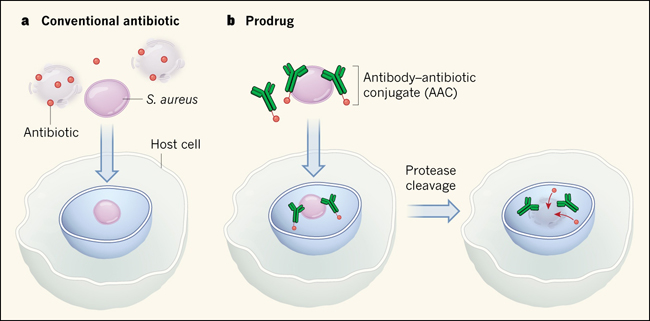
Figura 1: Liberación intracelular dirigida de antibiótico
a, las infecciones por Staphylococcus aureus son notoriamente difíciles de tratar. Se cree que esto es debido a que las bacterias entran en las células hospederas y se "ocultan" en compartimentos intracelulares a los que los antibióticos convencionales no pueden llegar o bien son inactivos. b, Lehar y colegas, unieron covalentemente un derivado de antibiótico, llamado rifalogue, a un anticuerpo que se une a los componentes de la pared celular de S. aureus. Este profármaco recubre la superficie celular bacteriana pero permanece inactivo hasta que las bacterias ingresan a la célula. En el interior, enzimas proteasas escinden la región enlazadora, liberando el antibiótico activo, el cual luego elimina a las bacterias.
Este enfoque es una reminiscencia de estrategias de profármacos dirigidas a anticuerpos actualmente utilizadas en la terapia para el cáncer, y éstas prueba sugieren que la entrega de antibióticos específicos es una estrategia prometedora para la lucha contra patógenos intracelulares persistentes. Sin embargo, debe determinarse si el CAA es tan eficiente en el tratamiento de infecciones bacterianas en seres humanos como en ratones, especialmente en pacientes con infección crónica, que a menudo ya tienen anticuerpos contra S. aureus. Tales anticuerpos pueden proteger la superficie bacteriana de una unión al CAA, y por lo tanto, interferir con la terapia. Por otra parte, debido a que el antibiótico representa sólo alrededor del 1% (en masa) del constructo, el AAC tendría que ser aplicado en el equivalente de más de un gramo por dosis para un paciente adulto. Esto podría mejorar en el futuro mediante la sustitución del anticuerpo con entidades que se unan a superficies más pequeñas.
¿Por qué es mucho más efectivo el enfoque del CAA que los antibióticos estándar? Una razón es que el rifalogue es más eficiente que la rifampicina en matar células infectadas con S. aureus persistente. Otro motivo es que la cinética de la distribución de drogas, la excreción y la inactivación parecen ser favorecidas por su fusión al anticuerpo. El recubrimiento de células bacterianas con el profármaco unido al anticuerpo también puede facilitar la incorporación de bacterias hacia compartimentos intracelulares (lisosomas) que tienen altos niveles de enzimas necesarias para liberar el antibiotico. Finalmente, la acumulación del CAA en la superficie de los patógenos puede causar particularmente elevadas concentraciones locales de bacterias en el escondite intracelular. Sin embargo, aún queda por determinar si estos mecanismos dan cuenta de la potencia in vivo de este complejo antibiótico-anticuerpo.
En comparación con la terapia convencional, el enfoque de este profármaco probablemente pueda reducir tanto la aparición de resistencia (mediante la reducción de la exposición de otra bacterias a la droga activa) y la disrrupción de comunidades normales de microorganismos del cuerpo. Todavía hay un amplio margen para la optimización de la direccionalidad terapéutica y de los enlaces químicos del complejo. Por otra parte, la estrategia puede permitir a los investigadores revestir antimicrobianos antiguos que no fueron desarrollados como terapia porque tenían una desfavorable farmacocinética o toxicidad. El enfoque CAA también podría ampliar el arsenal contra otros patógenos intracelulares de relevancia, tales como Mycobacterium tuberculosis.
Finalmente, las estrategias alternativas para hacer frente al creciente problema de la resistencia antibiótica también son emergentes. Estas incluyen antibióticos dirigidos específicamente a células con infección persistente, agentes que estimulan las defensas antimicrobianas del hospedero para aumentar la terapia antibiótica o agentes inofensivos "de control biológico" que colonizan al hospedero inhibiendo el crecimiento del patógeno. Se puede esperar que estos enfoques, junto con la estrategia del complejo anticuerpo-antibiótico, refuercen la capacidad para tratar infecciones bacterianas.
Fuente bibliográfica
Antibiotics: Homed to the hideout
Wolf-Dietrich Hardt.
Institute of Microbiology, ETH Zürich, 8093 Zürich, Switzerland.
Nature. 2015 Nov 19;527(7578):309-10