Diseminación celular temprana alimenta la metástasis
La evidencia actual sugiere que la diseminación metastásica a menudo occure en fases tempranas durante la formación de los tumores, pero aún no se han abordado los mecanismos de propagación de estas células incipientes anómalas. Utilizando un modelo animal para el estudio del cáncer de mama impulsado por el receptor del factor de crecimiento epidermal humano 2 (HER2) se ha observado que la señalización inducida por progesterona desencadena la migración de las células cancerosas desde lesiones tempranas por un corto período tras la activación de HER2, pero potencia la proliferación de células tumorales primarias avanzadas. Además, se ha determinado que el switch de migración hacia proliferación está regulado por la alta expresión de HER2 y por la densidad de células tumorales. Las células de tumores primarios de baja densidad muestran más características de stemness (troncalidad), migran más y establecen más metástasis que las células de tumores densos establecidos o avanzados. En particular, se encontró que al menos el 80% de las metástasis se derivan de células cancerígenas de diseminación temprana. Análisis cariotípicos y fenotípicos de células diseminadas y de los tumores primarios de pacientes corroborarán la relevancia de estos cruciales hallazgos para esta letal forma de propagación del cáncer.
Cáncer de mama metastásico
En 2015, alrededor de 232.000 mujeres en los Estados Unidos recibieron un diagnóstico de cáncer de mama invasivo, y aproximadamente 40.000 murieron por la forma metastásica de esta neoplasia. La principal causa de estos decesos fue la diseminación metastásica. El momento y la distribución de la metástasis en el cáncer de mama varían considerablemente. En aproximadamente el 5% de las mujeres con esta enfermedad, las metástasis son clínicamente evidentes al momento del diagnóstico. En otras, la metástasis se vuelve aparente años o incluso décadas tras el diagnóstico inicial. Además, el número de metástasis varía considerablemente.
Los mecanismos que dan cuenta de la amplia variabilidad en la propensión de que el cáncer de mama se vuelva metastásico son desconocidos, aunque se sabe que la diseminación metastásica de un tumor primario puede ocurrir en fases tempranas, que son asintomáticas y que se caracterizan por la propagación de células que se depositan en la médula ósea, donde pueden permanecer latentes durante años antes de volverse clínicamente evidentes. En dos recientes estudios (doi: 10.1038/nature20785 y doi: 10.1038/nature20609) Hosseini y Harper junto a sus respectivos equipos otorgaron pistas sobre el proceso metastásico de las células del cáncer de mama que se establecen con éxito en la médula ósea (figura 1).
Los mecanismos que influyen en la aparición de metástasis en el cáncer de mama incluyen la expresión de la proteína de superficie llamada receptor del factor de crecimiento epidermal humano 2 (HER2, por sus siglas en inglés), un receptor transmembrana con actividad tirosina quinasa. HER2 aumenta el potencial metastásico de células del cáncer de mama. Las células que expresan HER2 son más propensas a la metástasis que aquellas que son HER2 -.
Existe una visión respaldada desde hace mucho tiempo que sustenta que el aumento del comportamiento maligno durante el curso de una neoplasia se relaciona con la etapa de adquisición por las células del cáncer de variantes que predisponen a la adpoción de variantes adicionales que confieren comportamiento maligno y metastásico. Este modelo de "cascada" puede ser propio de algunos tumores, pero ha sido cuestionada en el caso del cáncer de mama. El modelo predice que un subconjunto de mutaciones en el tumor primario también se encuentran en las células metastásicas. Sin embargo, estas últimas pueden adquirir mutaciones independientes - un fenómeno conocido como progresión paralela. Por lo tanto una interrogante válida es si muestras de un tumor primario, de sangre, o metastásicas deberían ser utilizadas para el análisis molecular de guía de la terapia.
Los estudios de Hosseini y Harper destacan la importancia de las células de un tumor temprano y el establecimiento y proliferación de estas células en el sitio de la metástasis. Los experimentos de Hosseini y sus colegas realizados en ratones diseñados para expresar altos niveles de de HER2 ortóloga de rata en células epiteliales mamarias. Estos ratones son propensos al cáncer de mama y por lo tanto son usados como modelo experimental para estos casos.
Los autores observaron que el 80% de los ratones tenían metástasis de médula ósea surgida a partir de células que se diseminaron desde una lesión neoplásica temprana en el epitelio mamario tras la inducción de la expresión de HER2. Además, se encontró que Wnt4 y el activador del receptor del ligando del factor nuclear κβ (RANKL) son secretados por las células tumorales tempranas que expresan HER2 y el receptor de progesterona, lo que promueve la diseminación de células que no expresan este receptor hormonal desde la lesión tumoral. WNT4 apoya la proliferación celular, la supervivencia y la diferenciación así como la carcinogénesis; mientras que RANKL contribuye a la supervivencia de las células metastásicas.
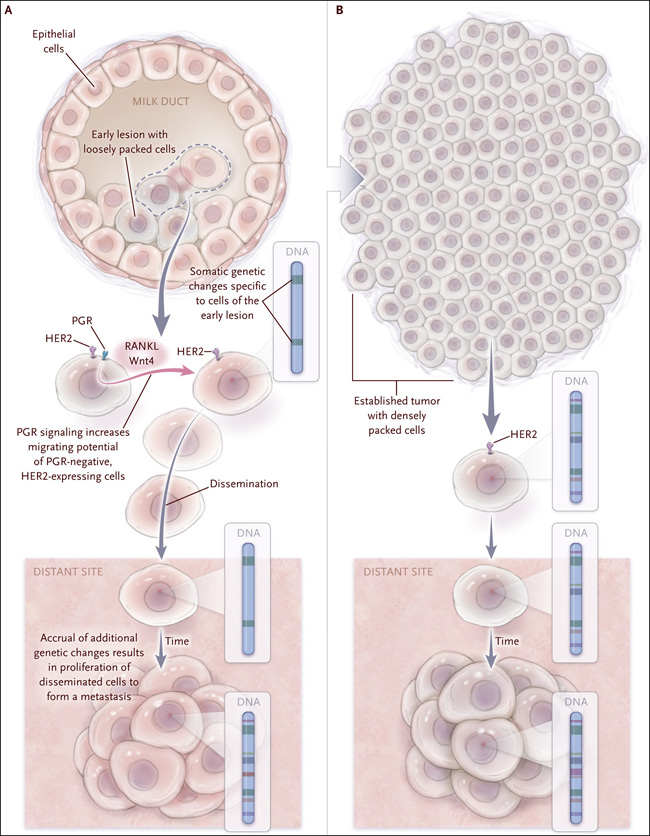
Figura 1: un modelo de progresión paralela después de una diseminación temprana.
Recientes experimentos con un modelo de ratón con cáncer de mama que expresa el receptor del factor de crecimiento epidérmico humano 2 (HER2) han logrado descifrar eventos críticos relacionados con la diseminación de células tumorales a partir de una lesión neoplásica temprana (panel A) y células de tumores establecidos (panel B). Algunas de las células en la lesión temprana expresan el receptor de progesterona (PGR) además de HER2. Estas células PGR-positivas secretan factores solubles, como el activador del receptor del ligando del factor nuclear κβ (RANKL) y Wnt4, que inducen la migración de células PGR-negativas desde la lesión. Las células en el tumor establecido (panel B) se empaquetan con más fuerza, típicamente no expresan PGR, y son menos propensas a la metástasis. Las células que difunden desde tumores establecidos hacia la médula ósea llevan muchas de las variantes y alteraciones genéticas como la pérdida del cromosoma 8p, que se encuentran en tumores establecidos, mientras que aquellas que se diseminan desde lesiones tempranas no son portadoras de estos defectos y evolucionan paralelamente con el tumor primario y otras células diseminadas.
Hosseini y colegas encontraron que aunque las células en lesiones tempranas eran propensas a la metástasis, su contraparte en tumores tardíos son mucho menos propensos a diseminanarse desde el tumor, manteniéndose in situ y proliferando. Estas células expresan robustamente HER2 y carecen del receptor de progesterona. Los autores también descubrieron que la supresión de esta proteína en tumores tardíos está mediada por una elevada expresión de HER2.
En el artículo de Hosseini y colegas el análisis de células cancerosas diseminadas que se aislaron de mujeres que habían recibido un diagnóstico de cáncer de mama (con y sin metástasis) mostró que las células diseminadas aisladas de mujeres sin metástasis no portan cambios cromosómicos encontrados en el tumor primario, como la pérdida del cromosoma 8p. En contraste, el análisis de las células aisladas de pacientes con metástasis mostró que tenían un perfil genético similar a las células del tumor primario. Este hallazgo apoya la hipótesis de que las células cancerosas que se difunden desde la lesión temprana siguen un camino independiente, o en paralelo, de su evolución genética respecto a células del tumor primario.
Utilizando un modelo de ratón similar al utilizado por Hosseini y sus colegas (en el que HER2 se expresa en los conductos mamarios), Harper y su equipo encontraron que las células HER2-positivos examinadas tempranamente durante la evolución del cáncer de mama en ratones, activan un programa diseminación dependiente de Wnt. Ambos autores concluyeron que las vías de señalización dependientes de progesterona pueden activar a HER2, lo que a su vez activa procesos que favorecen la metástasis (como el debilitamiento de la adhesión celular).
Finalmente, Hosseini, y sus colegas también encontraron que la densidad de células (el número de células por unidad de volumen, que es elevada en tumores establecidos versus las lesiones tempranas) influye en la expresión de receptores de progesterona y a la propensión de metástasis. Por lo que un análisis fenotípico de células cancerosas diseminadas y de tumores primarios de pacientes podría corroborar la relevancia de estos notables hallazgos para la diseminación metastásica en los seres humanos.
Fuente bibliográfica
Timing of Metastasis in Breast Cancer
Robert S. Schwartz, M.D., and John K. Erban, M.D.
Tufts University, Boston.
DOI: 10.1056/NEJMcibr1701388