Detección de trisomías
En 1997, el Dr. Yuk Ming Dennis Lo y colegas informaron que pequeños fragmentos de ADN extracelular de la placenta en desarrollo están presentes en la circulación materna. Esto condujo a una revolución en el campo de la detección prenatal, lo que ha sido reconocido por la Fundación Lasker, que le otorgó al profesor el Premio de Investigación Médica Clínica 2022 Lasker-DeBakey.
Durante años se había seguido una estrategia diferente: los investigadores intentaban extraer células fetales intactas circulantes, impulsados por la creencia de que serían accesibles en una simple muestra de sangre y podrían analizarse para el diagnóstico fetal sin necesidad de ensayos invasivos como la amniocentesis. Sin embargo, la identificación, extracción y análisis de tales células resultó difícil de alcanzar. El descubrimiento marcó una nueva vía de investigación y, durante los siguientes 14 años, se fueron confirmando tales hallazgos, se desarrollaron métodos para el análisis de ADN fetal libre de células (cfDNA, por sus siglas en inglés) para identificar trisomías fetales y se completaron grandes estudios de validación clínica. Las primeras pruebas clínicas de detección estuvieron disponibles en 2011.
Los esfuerzos para mejorar la detección se han visto impulsados por el hecho de que las trisomías, incluida la 21 (también llamada síndrome de Down), se encuentran entre las causas más comunes de resultados adversos del embarazo. Inicialmente, las pruebas prenatales para trisomías solo estaban disponibles a través de la amniocentesis, que conlleva un riesgo de aborto espontáneo, y la detección se basaba únicamente en la edad materna. La exploración de aneuploidías mejoró con avances que involucraron marcadores séricos y ultrasonográficos no específicos. Los primeros, más efectivos, involucran una combinación de seis analitos séricos (dos que se obtienen en el primer trimestre y cuatro en el segundo) y un marcador ultrasonográfico (medición de la translucencia nucal), cada uno de los cuales se mide dentro de una edad gestacional determinada. Este enfoque tuvo una tasa de detección del 93% y una tasa de falsos positivos del 5%. Aunque la tasa de detección de este método fue razonablemente alta, su implementación es compleja, dada la necesidad de dos muestras de sangre obtenidas por separado y un examen ultrasonográfico, que generalmente se programan en diferentes momentos y en diferentes lugares. Además, la tasa de falsos positivos del 5% significaba que el valor predictivo positivo era solo de aproximadamente el 3%. Es decir, de cada 20 pacientes a los que se les realiza cribado, una tuvo que decidir si hacerse una prueba diagnóstica invasiva, y de las que recibieron un resultado positivo y optaron por obtener la confirmación diagnóstica mediante muestreo invasivo, el 97% obtuvo resultados normales.
Todo esto cambió con el descubrimiento del cfDNA fetal circulante, derivado principalmente de la fragmentación y liberación de ADN genómico de células placentarias. Además del cfDNA que se libera de estas, también se da durante el recambio de rutina de las células normales de una persona. Otras fuentes incluyen tumores, órganos trasplantados y organismos infecciosos. Por lo tanto, el análisis del cfDNA de una paciente puede proporcionar información útil para el diagnóstico y seguimiento del cáncer, la evaluación del rechazo del injerto de trasplante y el diagnóstico de enfermedades infecciosas, además de la detección prenatal de trisomías. El potencial para la detección y control del cáncer se reconoció en 1948, cuando se informó por primera vez de su existencia. Dicho esto, aunque el uso de cfDNA en el contexto de la atención del cáncer (y de los trasplantes) es un área de investigación emocionante, sigue siendo experimental y su uso en enfermedades infecciosas es raro.
El descubrimiento involucró el uso de la reacción en cadena de la polimerasa. La evaluación de las aneuploidías y, en última instancia, de otros trastornos genéticos fetales, requiere tecnologías mucho más sofisticadas; de hecho, el uso generalizado de cfDNA para la detección prenatal de aneuploidía solo fue posible gracias al desarrollo de la secuenciación de próxima generación, una forma de secuenciación de ADN poderosa, rápida y económica (figura 1).
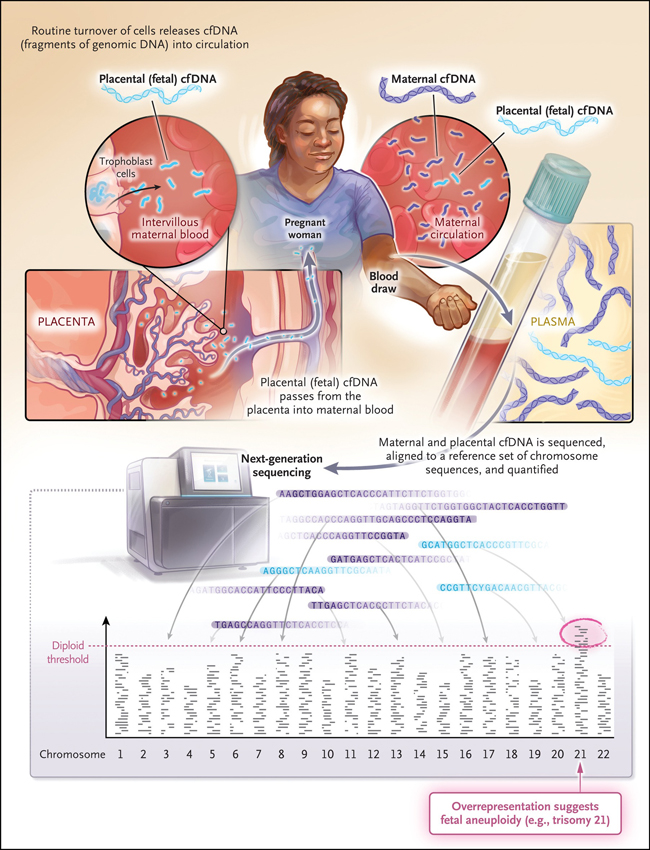
Figura 1: detección de trisomía 21 fetal con el uso de ADN libre de células en plasma materno.
Es posible detectar cfDNA de origen fetoplacentario de forma fiable en la circulación materna a las 9 semanas de gestación, y representa aproximadamente el 10% de todo el cfDNA en el suero materno en el segundo trimestre. Se utilizan varias técnicas diferentes y comparten una sensibilidad para la detección de trisomía 21 superior al 99%; para las trisomías 18 y 13 la sensibilidad es menor, aunque por encima del 90%. Uno de sus mayores beneficios es la altísima especificidad de más del 99,9 % para las tres trisomías. Menos de 1 de cada 1000 mujeres que se someten a pruebas reciben un resultado falso positivo para la trisomía 21, y la mayoría de los resultados positivos predicen con precisión un feto afectado. Este es un gran avance respecto a los anteriores enfoques de detección.
A la exploración prenatal de cfDNA se le reconoce como una "innovación disruptiva". Ciertamente, ha transformado la atención prenatal en los países y regiones donde está disponible. Su aplicación al cribado de trisomías ha sido seguida por nuevos avances. La detección de cfDNA ahora está disponible para muchos síndromes de microdeleción, deleciones y duplicaciones cromosómicas grandes y trastornos de un solo gen. Sin embargo, debido a que estas condiciones son más raras, la precisión de los resultados es menor, con una mayor cantidad de mujeres embarazadas que reciben resultados falsos positivos como en el caso de la trisomía 21. Un futuro en el que se pueda analizar la totalidad del genoma fetal con el uso de una sola muestra de sangre parece probable, aunque la utilidad de dicho recurso en muchos escenarios clínicos es incierta. Sin embargo, el análisis de cfDNA es claramente el método elegido para detectar trisomías y es un producto extraordinario e importante del presente descubrimiento.
Fuente bibliográfica
Circulating Cell-free DNA and Screening for Trisomies
Mary E. Norton, M.D.
Department of Obstetrics, Gynecology, and Reproductive Sciences, University of California, San Francisco, San Francisco.
DOI: 10.1056/NEJMcibr2209405