Cuerpo y bacterias: una amistad de hierro
Dilucidar los beneficios de las moléculas derivadas de la microbiota para comprender la simbiosis entre bacterias y seres humanos es actualmente un tema de gran relevancia en medicina. La molécula enterobactina (Ent) secretada por bacterias es un sideróforo quelante de hierro con presuntos efectos negativos en las células huéspedes. Sin embargo, la alta prevalencia de bacterias comensales productoras de Ent en el intestino humano sugiere un posible mecanismo en el que la célula hospedante pueda beneficiarse de Ent. Recientemente, se ha descubierto un rol inesperado y sorprendente de Ent en el apoyo al crecimiento y metabolismo del hierro en el nemátodo C. elegans, un relevante modelo experimental para el estudio de patologías humanas. Se demostró que Ent promueve la absorción mitocondrial de hierro al unirse a la subunidad α de la ATP sintasa. Interesantemente, también se demostró la ocurrencia de este mecanismo en células de mamíferos, lo que evidencia la conservación de este vía de transporte férrico entre especies. Este estudio revela un paradigma distinto a la competencia por el hierro entre bacterias comensales y sus huéspedes, y un mecanismo importante para la absorción mitocondrial de hierro con fines homeostáticos.
El sideróforo enterobactina
Casi todas las formas de vida, desde las bacterias hasta los mamíferos, tienen un requerimiento absoluto de hierro, y una serie de mecanismos -a veces bastante elaborados- han evolucionado para asegurar que obtengan suficiente de este mineral para sobrevivir. Una estrategia eficaz utilizada por bacterias, hongos y algunas plantas es la secreción de compuestos quelantes de alta afinidad conocidos como sideróforos. Después de la unión del hierro en el ambiente extracelular, el complejo sideróforo-hierro es transportado a la célula a través de una vía de transporte específica. La bacteria entérica común Escherichia coli y algunas otras bacterias producen un sideróforo conocido como enterobactina, que permite al organismo obtener cantidades suficientes de hierro para sobrevivir en un ambiente donde los niveles pueden ser muy bajos.
Aunque la mayoría de las cepas de E. coli y muchos otros tipos de bacterias son inofensivas para los humanos, algunas son patógenas, y estos microorganismos también requieren hierro, que obtienen de su huésped. En respuesta, los organismos superiores han desarrollado varios métodos para privar de hierro a los microbios invasores. Uno de ellos es la síntesis de una proteína conocida como lipocalina-2, que puede secuestrar los complejos hierro-sideróforo, haciéndolos inaccesibles para las bacterias. La batalla por el hierro entre la bacteria y su huésped puede resumirse de la siguiente manera: el microbio secreta sideróforos para maximizar su suministro de hierro, mientras que el huésped se esfuerza por mantener a sus “inquilinos” bajo control limitando ese suministro.
Un estudio reciente de Bin Qi y Min Han (DOI: 10.1016/j.cell.2018.07.032) revela otra capa de complejidad en esta relación. Utilizaron un novedoso ensayo de metabolitos microbianos para examinar sus efectos sobre el crecimiento del gusano experimental Caenorhabditis elegans. Evidenciaron que la enterobactina producida por E. coli era capaz de mejorar el crecimiento de C.elegans y a través de una serie de experimentos demostraron que el sideróforo estimula la acumulación de hierro dentro de las mitocondrias de las células del gusano (la mitocondria juega un papel importante en la homeostasis del hierro celular). Interesantemente, esta acumulación dependía de una enzima mitocondrial, la subunidad α de la ATP sintasa. El complejo enterobactina-hierro fue capaz de unirse directamente a esta proteína. Sobre la base de sus datos, los autores estimaron que la unión de la enterobactina férrica a la subunidad α de la ATP sintasa α proporciona un mecanismo para la retención de hierro dentro de las mitocondrias. También demostraron que el hierro suministrado por enterobactina podía incorporarse a las enzimas mitocondriales del grupo hierro-azufre aconitasa y succinato deshidrogenasa, aumentando así su actividad. Por lo tanto, el hierro entregado a las células huéspedes por la enterobactina puede ser utilizado dentro de las mitocondrias. Sin embargo, aún no se ha resuelto con precisión cómo el complejo sideróforo-hierro entra en las células y mitocondrias, y cómo su hierro puede ser utilizado para la síntesis de clusters de hierro-azufre y potencialmente para la síntesis del grupo hemo.
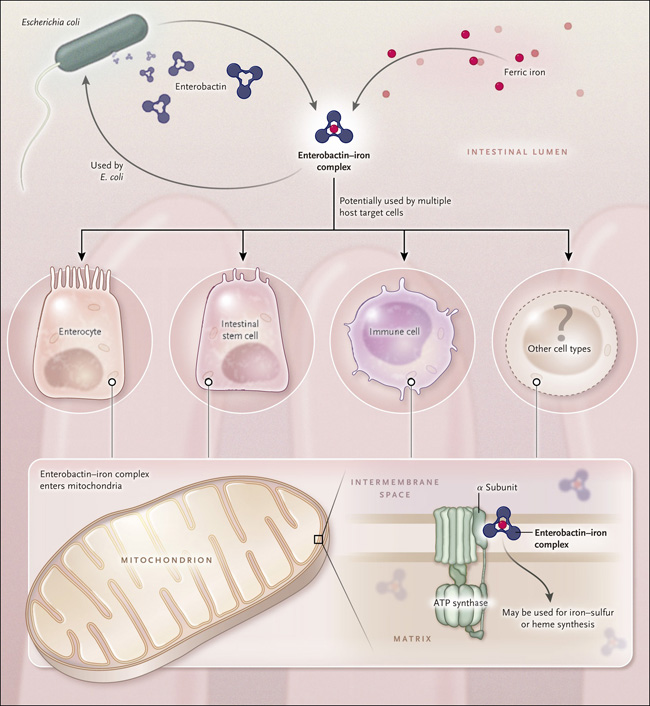
Figura 1. Rivalidad bacteria-hospedero por el hierro.
Escherichia coli en el lumen intestinal excreta el compuesto de unión al hierro enterobactina. La bacteria puede utilizar el complejo enterobactina-hierro para ayudar a satisfacer sus propias necesidades, pero el complejo también es capaz de interactuar con el huésped. Sin embargo, se desconoce si es preferentemente usado por algunos tipos celulares específicos o si tiene efectos más generales. Independientemente de su célula diana, la enterobactina férrica es capaz de entrar en las mitocondrias, donde puede unirse a la subunidad α de la ATP sintasa. Esto facilita la acumulación de hierro dentro de los organelos, donde puede ser utilizado para la síntesis de clusters de hierro - azufre y posiblemente de hemo. Estos grupos protésicos pueden ser incorporados en un rango de enzimas dependientes del hierro. Este sistema representa un ejemplo de cómo el huésped utiliza un metabolito microbiano para apoyar su propio crecimiento y desarrollo.
Los investigadores han desarrollado los primeros pasos para demostrar si esta vía de liberación de hierro ocurre en células de mamíferos y si es relevante para la fisiología humana, mostrando que la enterobactina puede facilitar la acumulación de hierro mitocondrial en una línea celular humana y que el equivalente humano de la ATP sintasa de C. elegans, ATP5A1, media este proceso. Por lo tanto, esta ruta parece estar muy bien conservado. El siguiente paso será determinar si existe un efecto fisiológicamente relevante de la enterobactina férrica en mamíferos y, de ser así, determinar la identidad de sus células diana. En el caso de una bacteria entérica como E. coli, las células huéspedes más propensas a beneficiarse de la enterobactina férrica son las de la mucosa intestinal. La mayoría de las células epiteliales maduras tienen una vida muy limitada - unos pocos días como máximo - por lo que pueden tener una necesidad limitada de un suministro adicional de hierro. Sin embargo, una variedad de otros tipos de células podrían beneficiarse potencialmente, incluyendo las células madre intestinales, las células parietales y las células inmunitarias de la mucosa.
La íntima relación entre el microbioma intestinal y el funcionamiento normal de su huésped es ahora ampliamente apreciada. Dado que esta asociación se ha desarrollado durante un período muy largo, no es sorprendente que el huésped y el microbio hayan desarrollado una relación simbiótica. Será necesario seguir trabajando para determinar si el huésped se beneficia realmente de la utilización del sideróforo. Sin embargo, la situación es potencialmente compleja. La composición del microbioma intestinal puede variar en respuesta a cambios en la dieta o en el estado de la enfermedad, y esto podría influir en la capacidad de las bacterias entéricas para producir enterobactina. El contenido de hierro de la dieta también puede influir en la producción de sideróforos tanto directamente (la mayoría de los sistemas de sideróforos están regulados a la baja cuando el hierro es abundante) como indirectamente (mediante la alteración de la composición de la microbiota). También, los autores plantean la posibilidad de que enterobactinas exógenas puedan ser utilizadas para tratar la deficiencia de hierro, pero su viabilidad dependerá, entre otras cosas, de una comprensión profunda de la asociación entre el hierro, microorganismos intestinales y las células que los alojan.
Fuente bibliográfica
Iron Wars — The Host Strikes Back
Gregory J. Anderson, Ph.D.
Iron Metabolism Laboratory, QIMR Berghofer Medical Research Institute, Brisbane, QLD, Australia.
DOI: 10.1056/NEJMcibr1811314