Chequeo perinatal de la microbiota
Probablemente ningún cambio en la vida de una persona sea tan crítico como el momento de su nacimiento. A medida que un bebé sale del canal de parto, el recién nacido pierde el soporte placentario y el sistema respiratorio y el intestino deben comenzar a funcionar. Además, desde ese momento se desarrollarán microorganismos beneficiosos y patógenos que competirán para colonizar el cuerpo del bebé. En un reciente artículo se muestra que la proteína TLR5 participa activamente en dar forma a la composición a largo plazo de la comunidad microbiana del intestino, en ratones recién nacidos.
TLR5
La colonización bacteriana del intestino normalmente comienza en el canal de parto. Luego, ocurren sucesivas olas de aumentos y disminuciones en las especies microbianas durante un período de cambio microbiano, que dura aproximadamente 18 meses en los seres humanos. Las condiciones nutricionales y el desarrollo del sistema inmunológico en los primeros años de vida afectan a la colonización intestinal, con consecuencias de gran alcance para el crecimiento y la salud posteriores.
Más de 15 millones de niños menores de 5 años de todo el mundo sufren desnutrición y emaciación severa (go.nature.com/2n3rxob). Esto es causado por una combinación de ingesta insuficiente de calorías y un tipo de disfunción inmunológica que está ligada a una colonización bacteriana anormal en el intestino, llamada enteropatía ambiental. El correcto funcionamiento de las células inmunitarias como las células B y células T se determina en parte por la exposición durante su desarrollo temprano a microbios no patógenos, lo que puede tener consecuencias a largo plazo para la composición de las especies que conforman la microbiota y en los procesos posteriores de resistencia frente a desafíos contra patógenos.
El sistema inmunológico inmaduro y vulnerable de un recién nacido puede, hasta cierto punto, estar protegido del ataque patógeno por la presencia de anticuerpos maternos, transferidos a través de la placenta o en la leche, una medida especialmente eficaz para mejorar la salud. Los anticuerpos de la leche que permanecen en el intestino pueden ayudar a determinar la composición de los microbios que colonizan el intestino y, por lo tanto, prevenir una respuesta inmunitaria excesiva a los microbios no patógenos. Sin embargo, a pesar de esta protección inmunológica proporcionada por la madre, un bebé todavía se enfrenta a un período extremadamente sensible en los primeros años de vida, cuando la colonización microbiana progresiva de las superficies internas y externas del cuerpo ocurre simultáneamente con el desarrollo y la maduración del sistema inmunológico.
La composición y función celular de casi todos los órganos cambia cuando un animal libre de gérmenes se coloniza con una microbiota. Estos cambios son desencadenados por las moléculas de los propios microbios, y los resultados pueden ayudar a prevenir la inflamación a medida que el animal se adapta a la presencia de bacterias en la superficie de su cuerpo.
Anteriormente se pensaba que la adaptación de los tejidos del huésped para acomodar la presencia de microbios intestinales podía ocurrir con la misma eficacia a cualquier edad, sobre la base de experimentos que introdujeron una microbiota en animales adultos criados en condiciones libres de gérmenes. Sin embargo, cada vez se es más consciente de que, a medida que se desarrolla un animal recién nacido, se requiere una secuencia ordenada y dependiente de la edad de puntos de control inmunológicos y microbianos interrelacionados para una adaptación adecuada y para garantizar una composición microbiana saludable. Ejemplos de adaptaciones en la crucial ventana de tiempo inicial incluyen la regulación de la inducción de diferentes clases de anticuerpos llamados isotipos y del número de células T asesinas naturales (NKT) en el intestino. La colonización microbiana del animal recién nacido no es necesaria para que se desarrolle la rama innata del sistema inmunológico, porque las moléculas de los microbios maternos que se encuentran en la placenta y en la leche pueden ser suficientes para impulsar algunos de estos procesos.
Estudios previos en ratones con deficiencia de TLR5, un receptor perteneciente a una familia ligada al reconocimiento microbiano, han mostrado que las bacterias intestinales en dichos animales tienen defectos que desencadenan anormalidades metabólicas tales como aumento de peso corporal y cambios grasos en el hígado. Para investigar cómo el desarrollo postnatal afecta el establecimiento de la comunidad microbiana intestinal, Fulde y sus colegas (DOI: 10.1038/s41586-018-0395-5) compararon la expresión génica en las células epiteliales intestinales de ratones de tres días de edad con la de ratones adultos, y encontraron que el gen que codifica TLR5 tiene una alta expresión en los ratones jóvenes. Luego, los autores investigaron si esta proteína tiene un papel en el desarrollo intestinal postnatal temprano.
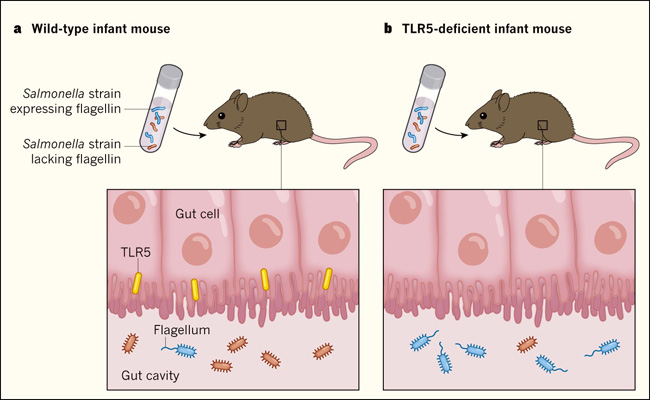
Figura 1. Una proteína huésped afecta la composición de la comunidad microbiana intestinal.
Fulde y colegas muestran que la expresión de la proteína TLR5 en células intestinales durante un período de tiempo limitado en el desarrollo postnatal temprano en ratones ayuda a reducir la presencia de bacterias que expresan la proteína flagelina. Esta proteína es un componente de una estructura bacteriana llamada flagelo, y es un sello de las bacterias patógenas, aunque no todas las bacterias que expresan flagelina son nocivas. a, b, Cuando los autores dieron a ratones de tipo silvestre o con deficiencia de TLR5 una muestra bacteriana que era una mezcla igual de cepas flagelares y no flagelares de Salmonella, encontraron que una proporción más alta de bacterias que expresan flagelina estaba presente en el intestino de los ratones con deficiencia de TLR5 (b) que en los ratones de tipo silvestre (a). Experimentos adicionales revelaron que la expresión temprana de TLR5 puede ayudar a formar la composición a largo plazo de las especies microbianas que residen en el intestino.
Fulde y sus colaboradores muestran que la expresión de TLR5 en las células epiteliales intestinales en los primeros años de vida es un ejemplo de un punto de control en un proceso de desarrollo que se coordina con la colonización microbiana para lograr un mutualismo saludable entre el huésped y su microbiota. TLR5 puede unirse a la proteína bacteriana flagelina, y los autores encontraron que esto impulsa la secreción de la proteína antimicrobiana Reg3γ. Tanto TLR5 como Reg3γ ayudan a limitar la colonización temprana por bacterias que expresan flagelina, que es un componente de la estructura flagelar que ayuda a la motilidad bacteriana. La flagelina se encuentra en algunas bacterias patógenas, aunque no todas las bacterias que expresan la flagelina son patógenas. Los autores determinaron en qué momento del desarrollo ocurre este efecto relacionado con TLR-5 al realizar experimentos de colonización en los que ratones recién nacidos (de hasta 10 días de edad) recibieron una mezcla igual de cepas no flageladas y flageladas de la bacteria Salmonella. En ratones de tipo silvestre , la colonización intestinal de la cepa que carecía de flagelina fue consistentemente mayor que la de la cepa que si contenía flagelina. Esta diferencia no se observó en ratones con deficiencia de TLR5 (figura 1).
En suma, el trabajo de Fulde y sus colegas ofrece dos mensajes clave. En primer lugar, muestra que la expresión de TLR5 en los primeros años de vida puede tener un efecto duradero en la composición de la comunidad microbiana intestinal. Y en segundo lugar, apoya la idea emergente de hitos secuenciales durante el desarrollo postnatal mutuamente conectado de un huésped y sus microbios asociados.
Fuente bibliográfica
Checkpoint for gut microbes after birth
Andrew J. Macpherson & Stephanie C. Ganal-Vonarburg
University Clinic for Visceral Surgery and Medicine, Bern University Hospital, and in the Department for BioMedical Research, University of Bern, 3008 Bern, Switzerland.
DOI: 10.1038/d41586-018-05861-z