Bacterias sincronizadas para curar
La investigación para el diseño de fármacos contra diversas enfermedades ha llegado al punto de utilizar bacterias capaces de administrar moléculas de una forma específica y controlada. Este evento se ha logrado gracias al conocimiento de circuitos genéticos, que imitan un mecanismo esencial para los microorganismos: la percepción de quórum, utilizado para coordinar la expresión de sus genes en respuesta a la densidad y crecimiento bacteriano. En estudios recientes, se han diseñado programas de expresión génica en cepas atenuadas de Salmonella, de forma de controlar la liberación de una toxina de manera cíclica y sincronizada. Esto ocurre gracias al censo poblacional de las mismas bacterias: cuando se alcanza una densidad crítica umbral, se activan genes que conducen a la síntesis de la toxina y a su posterior liberación mediante la lisis de las células bacterianas. Estos hallazgos establecen una relevante metodología para el aprovechamiento de herramientas moleculares para explotar la tendencia natural que poseen determinadas bacterias para colonizar sitios patológicos.
Entrega cíclica de fármacos
Los seres humanos y las bacterias tienen una larga historia de relación parasitaria y simbiótica. Recientemente M. Omar Din y colaboradores (Nature. 2016 Aug 4;536(7614):81-5) exploraron en mayor profundidad el vínculo entre las bacterias y las enfermedades tisulares humanas bajo una mirada terapéutica. Los investigadores esbozaron un sistema en el que las bacterias actúan como vehículos de administración de fármacos y en el que ocurre una lisis bacteriana en simultáneo, lo que posibilita la liberación de un fármaco antitumoral de manera cíclica para maximizar suentrega con una baja toxicidad.
En el cuerpo, algunos nichos para las bacterias - tales como el lumen anaeróbico de los intestinos - tienen niveles bajos de oxígeno. Similares condiciones se encuentran en los tumores sólidos a causa del aumento de la demanda de oxígeno por parte de células tumorales altamente proliferativas y debido al suministro insuficiente de sangre dado la vasculatura estructural y funcionalmente alterada en estos casos. Las áreas hipóxicas en un tumor están relativamente protegidas de ataques por parte del sistema inmunológico, facilitando aún más la colonización bacteriana.
La idea de utilizar bacterias para combatir el cáncer existe desde hace más de un siglo. En 1891, el cirujano William B. Coley infectó a pacientes con bacterias de Streptococcus en un intento de activar el sistema inmunitario para combatir el cáncer. El método fue controversial debido a una eficacia inconsistente y a la toxicidad de la infección. Sin embargo, la idea resurgió después, cuando se conoció más sobre el microambiente tumoral y al surgir novedosas herramientas genéticas, elevando la esperanza de la producción de cepas bacterianas más potentes y menos tóxicas (atenuadas). A la fecha, se han desarrollado varias de estas herramientasellas como agentes terapéuticos contra el cáncer, mostrando efectos prometedores en modelos experimentales.
Las bacterias pueden destruir el tejido alterado compitiendo por los nutrientes, al secretar toxinas que provocan la activación de respuestas inmunes del hospedero. También pueden manipularse genéticamente para tener actividad anti-tumoral. Comparado con los virus, que también han sido utilizados en el tratamiento contra el cáncer, las bacterias tienen sustancialmente mayor capacidad para llevar ADN no nativo. Esta práctica, es habitual en biología molecular y consiste en introducir fragmentos de ADN de varios kilobases (kb) en un hospedero bacteriano, particularmente, en un cromosoma artificial bacteriano de tamaño superior a las 300 kb que puede ser transferido y mantenido en Escherichia coli. En principio, por lo tanto, las bacterias pueden servir de vehículos eficientes de administración de fármacos al llevar a circuitos genéticos que codifican y regulan cargas útiles terapéuticas.
Un sistema de administración de fármacos ideal para la terapia contra el cáncer debe suministrar la sustancia de forma selectiva al tumor para minimizar el daño a tejidos sanos, y además se debe liberarse de forma controlada. En su intento por desarrollar un sistema de este tipo, Din y colegas se centraron en los circuitos de percepción de quórum (quorum sensing), mecanismo que permite a las bacterias comunicarse unas con otras, por medio de la regulación de la expresión génica en respuesta a cambios en la densidad poblacional.
En un estudio anterior (Proc. Natl Acad. Sci. USA 89, 8794–8797 (1992)), los autores del actual trabajo utilizaron un enfoque biosintético para diseñar un circuito genético de quorum sensing en E. coli. Tres componentes tienen un rol clave en este circuito: LuxI, LuxR y la acil-homoserina lactona (AHL). La enzima LuxI cataliza la síntesis de moléculas de AHL, mientras que LuxR es un receptor proteico de AHL que activa un programa transcripcional de quorum sensing. Cuando la densidad poblacional bacteriana es baja, de LuxI se expresa a nivel basal. Las moléculas de AHL sintetizadas como resultado de la expresión de LuxI no se acumulan en la célula, sino que difunden rápidamente y se diluyen en el medio extracelular. Cuando la población bacteriana aumenta, AHL se acumula en las células debido a un menor gradiente de difusión a través de la membrana. Al llegar a una concentración umbral en la célula, AHL se une a LuxR. A su vez, LuxR activa una secuencia de ADN promotora llamada PluxI, que dirige la expresión de genes diana. Notablemente, debido a que AHL puede difundirse a través de la membrana, alcanza concentraciones similares en todas las células bacterianas durante el crecimiento de la población, asegurando la ejecución sincronizada de la expresión génica.
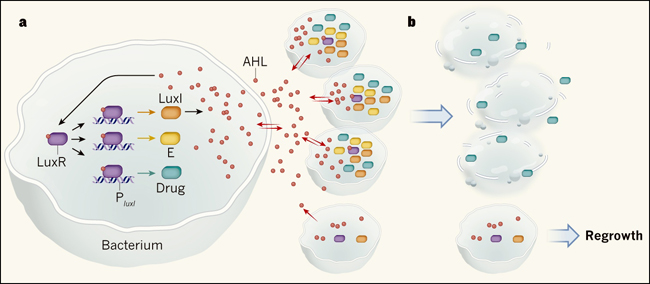
Figura 1. Lisis cíclica sincronizada y liberación del fármaco.
Din y colegas (Nature. 2016 Aug 4;536(7614):81-5) diseñaron un circuito genético en bacterias dirigidas específicamente hacia tumores, que media la producción de fármacos y y que permite su liberación a través de lisis celular sincronizada, por ciclos repetidos. a, la unión de la molécula de señalización AHL a su receptor proteico LuxR conduce a su posterior interacción con la secuencia de ADN promotora, PluxI. Este promotor dirige expresión del gen que codifica la enzima LuxI, que a su vez cataliza la síntesis de AHL, generando un bucle de retroalimentación. El promotor también conduce la expresión de genes que codifican una toxina bacteriana (fármaco) para eliminar células cancerosas, además de la proteína E, que libera el fármaco a través de la lisis de células bacterianas. La proteína AHL puede difundir libremente dentro y fuera de las células (flechas rojas). Cuando la densidad de la población bacteriana es baja, AHL principalmente difunde fuera de la célula y el circuito no está activo. Cuando la densidad de población aumenta, se acumula en el medio intracelular, alcanzando una concentración umbral que activa el circuito de la mayoría de las células. b, Las células se lisan coordinadamente, causando una liberación explosiva del fármaco. Las pocas bacterias que sobreviven dan comienzo a un nuevo ciclo.
En el estudio actual, los investigadores crearon una versión de este circuito genético el que controla la liberación sincronizada y cíclica de una toxina bacteriana en cepas atenuadas de Salmonella enterica serovar typhimurium. En este sistema, PluxI promueve la expresión de genes que codifican cuatro componentes - LuxI; el fármaco; una proteína fluorescente que permite el seguimiento de la dinámica poblacional y de la liberación del fármaco; y finalmente la proteína E, una macromolécula de lisis de un bacteriófago denominado φX174 (figura 1). Cuando la población bacteriana alcanza la densidad crítica umbral, el programa transcripcional dirigido por PluxI está activo en casi todas las células, conduciendo a la síntesis del fármaco y su posterior liberación debido a la ruptura de las células bacterianas. Solo unas pocas bacterias resisten este proceso, las que proliferan nuevamente en este nicho. El resultado es la lisis bacteriana cíclica y la administración de fármacos. Para demostrar la eficacia de esta estrategia, los autores trataron ratones portadores de tumores con las bacterias y observaron una dinámica de crecimiento poblacional cíclico y sincronizado, además de algunos beneficios terapéuticos. Estos hallazgos sucedieron al administrarse tanto en presencia como en ausencia de la quimioterapia.
Los autores no compararon directamente la eficacia de sus bacterias con la de los microbios diseñados de manera convencional, los que secretan de forma continua la proteína terapéutica. Las nuevas bacterias son notablemente diferentes a las convencionales. En primer lugar, la entrega del fármaco se logra mediante la lisis simultánea de toda la población, en lugar de la secreción continua por la proliferación individual. En segundo lugar, la lisis cíclica sirve como un mecanismo de seguridad, porque la mantención de la densidad bacteriana minimiza el riesgo de una respuesta inflamatoria sistémica que podría dañar al paciente.
A pesar de estas características, es poco probable que las bacterias por si solas puedan erradicar el tumor. En el estudio actual, el tratamiento de ratones con microbios diseñados por bioingeniería en combinación con la quimioterapia no fue capaz de destruir el tumor. En lugar de esto, el tumor se redujo en tamaño durante 18 días, después de lo cual volvió a crecer. Un enfoque terapéutico curativo debiese involucrar aún más mejoras en el diseño de estos microorganismos en combinación con la inmunoterapia u otros agentes contra el cáncer que sean más potentes.
La liberación cíclica del fármaco podría ser más útil para tratar a las personas que tienen enfermedades que requieren dosificación periódica, tales como la diabetes y la presión arterial elevada. Para tratar patologías no cancerosas, quizás los nichos naturales podrían ser colonizados por este tipo de bacterias. Alternativamente, el desarrollo de un casete implantable y semipermeable que pueda ser atravesado por proteínas y moléculas pequeñas, pero no por las bacterias, podría ser de gran utilidad para albergar estos microbios modificados. Uno de los retos de usar bacterias líticas para el tratamiento de enfermedades no cancerosas que requieren tratamiento a largo plazo es que la degradación bacteriana puede generar subproductos que pueden ser absorbidos y acumulados en la sangre, causando toxicidad sistémica. La elección de cepas bacterianas menos tóxicas o la creación de cepas atenuadas (por ejemplo, eliminando el gen msbB, que está implicado en la síntesis de endotoxinas) podrían superar este problema.
Fuente bibliográfica
Bacteria synchronized for drug delivery
Shibin Zhou
Sidney Kimmel Comprehensive Cancer Center and the Ludwig Center for Cancer Genetics and Therapeutics at the Johns Hopkins University School of Medicine, Baltimore, Maryland.
doi:10.1038/nature18915
Temas Relacionados