Avances clínicos por la reparación del ADN
Para mantener la integridad genómica, los quiebres ocurridos en la doble hélice del ADN deben ser reparados. En mamíferos, el análisis de este proceso se ha visto limitado por la incapacidad de introducir quieres bien definidos en el genoma. Sin embargo, utilizando enzimas –endonucleasas- de clivaje del ADN de cortes raros como I-SceI se ha posibilitado el monitoreo de la reparación del genoma. Los quiebres inducidos por esta enzima son reparados por mecanismos de recombinación homólogos. Actualmente se sabe que existen numerosos genes que participan en este proceso, cuya deficiencia es una característica definitoria de ciertos tumores. Estos hallazgos han impactado en una serie de áreas de estudio acerca de la dinámica del genoma de células tumorales, las que actualmente pueden ser categorizadas como de recombinación homóloga deficiente gracias al uso de marcadores específicos. Tal información, es crítica para determinar la estrategia terapéutica y evaluar su respuesta en oncología.
Recombinación
La recombinación entre cromosomas homólogos es esencial para el éxito de la meiosis. Impulsa la diversidad genética en las células de la línea germinal y proporciona el andamiaje necesario para la segregación precisa y equilibrada de los cromosomas parentales en productos meióticos. Sin embargo, su importancia en las células somáticas solo ha sido apreciada y entendida recientemente. Resulta que muchos genes implicados en la respuesta al daño del ADN codifican componentes de la vía de recombinación homóloga, y los defectos en estos genes resultan en predisposición al cáncer y a genomas alterados. Los tumores ahora pueden ser categorizados como de recombinación homóloga deficiente con el uso de biomarcadores específicos, información que es crítica para determinar la estrategia terapéutica y evaluar su respuesta. Por lo tanto, la recombinación homóloga es crucial para la salud humana en varios contextos.
El Premio Shaw 2019 en Ciencias de la Vida y Medicina reconoce el trabajo de la Dra. Maria Jasin del Memorial Sloan Kettering Cancer Center, pionera y líder en el campo de la recombinación homóloga de mamíferos. Demostró que la recombinación homóloga es mediadora de la recombinación meiótica y que BRCA1 y el BRCA2, que mutan en algunos cánceres hereditarios de mama y otros, son actores importantes en la recombinación homóloga. También desarrolló herramientas para caracterizar la recombinación homóloga en células de mamíferos. Es importante destacar que su trabajo -que mostró que las roturas en la doble hebra del ADN pueden ser reparadas mediante recombinación homóloga con el uso de una templado extracromosómico- sentó las bases para los métodos actuales de edición del genoma, como el sistema CRISPR-Cas9.
El gran avance de Jasin fue tomar el modelo de reparación de la ruptura del ADN de doble hebra desarrollado en levadura -en el que se reconoció que una rotura de este tipo era el evento iniciador en la recombinación homóloga- y hacer que el modelo funcionara en células de mamífero. Modificó una enzima de levadura, la meganucleasa I-SceI, que tiene un largo sitio de reconocimiento de ADN (una secuencia específica de 18 pares de bases), de modo que funcionaría en células de mamíferos (figura 1A) (Proc Natl Acad Sci U S A 1994;91:6064-6068). Trabajando con esta secuencia y la nucleasa, Jasin desarrolló una serie de reporteros genéticos que podrían detectar la recombinación homóloga entre dos genes orientados como repeticiones directas en el genoma.
Los reporteros de recombinación tenían dos características importantes: En primer lugar, los eventos de recombinación de baja frecuencia podrían seleccionarse directamente por resistencia farmacológica o, en versiones posteriores, detectarse por clasificación celular y fluorescencia. Segundo, la recombinación fue estimulada en gran medida cuando se expresó la enzima de restricción I-SceI. En otras palabras, la inducción de una ruptura de doble cadena en una localización cromosómica específica promovió la recombinación homóloga de alta frecuencia. Usando este sistema, Jasin examinó muchos genes reparadores del ADN para evaluar su participación en la recombinación homóloga. También tuvo la oportunidad de examinar las líneas de células tumorales deficientes en BRCA1 y BRCA2 y pudo demostrar que estos genes funcionan en la recombinación homóloga (DOI: 10.1016/s1097-2765(00)80202-6; DOI: 10.1016/s1097-2765(01)00174-5) Este hallazgo relacionó directamente los defectos de recombinación homóloga con la susceptibilidad al cáncer, lo que llevó a la comprensión de que la deficiencia de recombinación homóloga es una característica definitoria de ciertos tumores, lo que a su vez ha dado lugar a enfoques adaptados para el tratamiento de estos tumores.
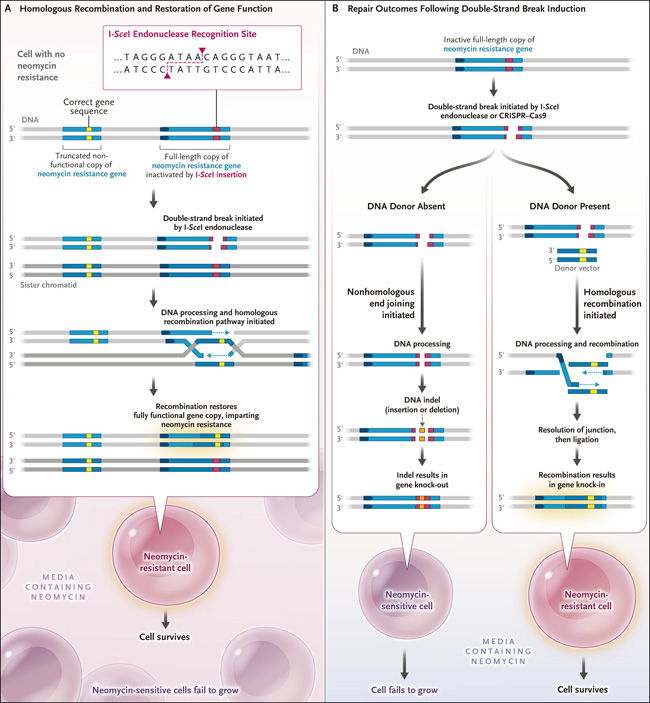
Figura 1. Resultados después de la inducción de las roturas de doble hebra.
Se representa una duplicación que consiste en dos genes de resistencia a la neomicina casi idénticos (panel A). El gen de la izquierda es truncado y no funcional, mientras que el de la derecha es un gen de longitud completa inactivado por la inserción de la secuencia de 18 pares de bases reconocida y escindida por la enzima I-SceI. La inducción de la enzima I-SceI y el clivaje en el sitio de reconocimiento dan como resultado la formación de una rotura de doble cadena; la recombinación homóloga entre las dos copias cambia la copia completa. La supervivencia celular en presencia de neomicina seguida de la validación de la secuencia de ADN indica que se ha producido la recombinación, una indicación que se denota por la transferencia de la secuencia correcta del gen (en amarillo) desde la copia truncada a la copia completa, reemplazando el sitio de reconocimiento de la endonucleasa I-SceI (en rojo). Se muestran dos modos de reparación que siguen a la inducción de una rotura de doble hebra (panel B). La inducción puede ocurrir a través del clivaje mediado por I-SceI o a través del sistema CRISPR-Cas9. Si no hay ningún donante de ADN presente, la ruptura se repara mediante la unión de extremos no homólogos, que añade o elimina nucleótidos en la rotura, eliminando la función del gen. Si hay un "donante" de ADN, se produce una recombinación entre el ADN del donante y el gen de resistencia a la neomicina que contiene la rotura de doble cadena, lo que da lugar a la reparación del gen y confiere resistencia al antibiótico a la célula.
En un estudio que resultó ser fundamental para el desarrollo de las tecnologías de edición genética, Jasin y sus colegas demostraron que una rotura genómica de doble cadena podía repararse mediante recombinación homóloga con el uso de una plantilla extracromosómica (DOI: 10.1128/mcb.14.12.8096). El segundo resultado importante de estos estudios fue el hallazgo de que no todas las reparaciones eran el resultado de una recombinación homóloga. De hecho, la mayoría de las roturas de doble hebra se reparan mediante la unión inexacta de los extremos, en un proceso llamado unión de extremos no homólogos (figura 1B). Aunque esto último puede parecer un resultado no deseado y un fracaso del sistema I-SceI, de hecho, ha resultado ser todo lo contrario. Los eventos de reparación de rupturas de doble hebra mostraron que, si se aprovecha correctamente, la reparación en células de mamíferos podría utilizarse tanto para inactivar genes (knockouts de genes) como para reparar defectos en ellos con el fin de restaurar la funcionalidad a través de la recombinación homóloga. Esto es precisamente lo que el sistema CRISPR-Cas9 puede hacer y por eso es tan popular.
La ventaja de este sistema es que el sitio de ruptura de doble hebra es impulsado únicamente por los ARN guía elegidos por el investigador y no está limitado por la necesidad de introducir en el ADN celular un sitio complicado de reconocimiento I-SceI o cualquier otro proceso de reconocimiento de enzimas. El sistema CRISPR-Cas9 en sus muchas variaciones puede ser utilizado para inactivar genes funcionales (a través de la unión final no homóloga) con el fin de estudiar lo que sucede cuando el gen no es funcional o para corregir un gen no funcional (a través de la recombinación homóloga) para restaurar la función. Este poderoso sistema de edición, por sí solo, tiene enormes implicaciones para la salud humana, y se basa en parte en el conocimiento de cómo se reparan las roturas de doble hebra en células de mamíferos, y que actualmente se producen gracias al trabajo de Maria Jasin.
Fuente bibliográfica
Recognition for Discoveries in DNA Repair
Hannah L. Klein, Ph.D., and Lorraine S. Symington, Ph.D.
New York University Medical Center, Department of Biochemistry and Molecular Pharmacology, New York, NY.
DOI: 10.1056/NEJMcibr1907358