Anticuerpos monoclonales para la malaria
Es una enfermedad devastadora. Causó 627.000 muertes a nivel mundial en 2020, y la mortalidad relacionada ha aumentado en más del 10% en los últimos 3 años. Aunque existen tratamientos altamente efectivos, el desarrollo de cepas multirresistentes representa una gran amenaza para su control y eliminación. A pesar de existir diversos enfoques para prevenir la infección, ninguno ofrece protección completa, por lo que se necesita de múltiples estrategias.
Para entender el objetivo del anticuerpo, es importante ubicarlo en el contexto del ciclo de vida del parásito de la malaria, Plasmodium falciparum. Este tiene dos huéspedes: el humano y el mosquito hembra del género anopheles, que también actúa como vector. Durante la picadura inicial (figura 1), el parásito se inyecta de la saliva del insecto en los tejidos del huésped en forma de esporozoíto y se inicia la infección. El esporozoíto pasa rápidamente al hígado, donde ataca las células hepáticas (hepatocitos). Durante los siguientes 5 a 10 días, el esporozoíto se divide asexualmente y el huésped humano no presenta síntomas clínicos.
A continuación, en forma de merozoítos, los parásitos se liberan en el torrente sanguíneo del huésped. Invaden los glóbulos rojos (eritrocitos), multiplicándose nuevamente antes de romperlos y liberar merozoitos a la sangre. Es la liberación sincrónica de merozoítos de los eritrocitos lo que causa la fiebre cíclica asociada con la malaria. En lugar de replicarse, algunos de los merozoitos se desarrollan en formas sexuales llamadas gametocitos que circulan en el cuerpo. Cuando un mosquito hembra pica a un humano infectado, toma los gametocitos de la sangre. Estos se desarrollan aún más dentro del mosquito y finalmente migran en forma de esporozoitos a las glándulas salivales del mosquito. Entonces el ciclo vuelve a comenzar.
Los anticuerpos monoclonales pueden actuar en tres puntos principales de este ciclo de vida: la etapa preeritrocítica (antes de la infección del hepatocito), la etapa eritrocítica asexual y la etapa eritrocítica sexual, cuando se forman los gametocitos y finalmente son absorbidos por el mosquito. Una picadura infecciosa inicial transmite pocos esporozoítos, por lo que la etapa preeritrocítica de la infección se considera el punto de intervención más manejable que la etapa sanguínea de la infección, cuando puede haber varios billones de parásitos. Sin embargo, la ventana dentro de la cual se puede brindar protección, entre la picadura inicial y la invasión de los hepatocitos, es menos de una hora, y se requieren niveles circulantes constantes de anticuerpos.
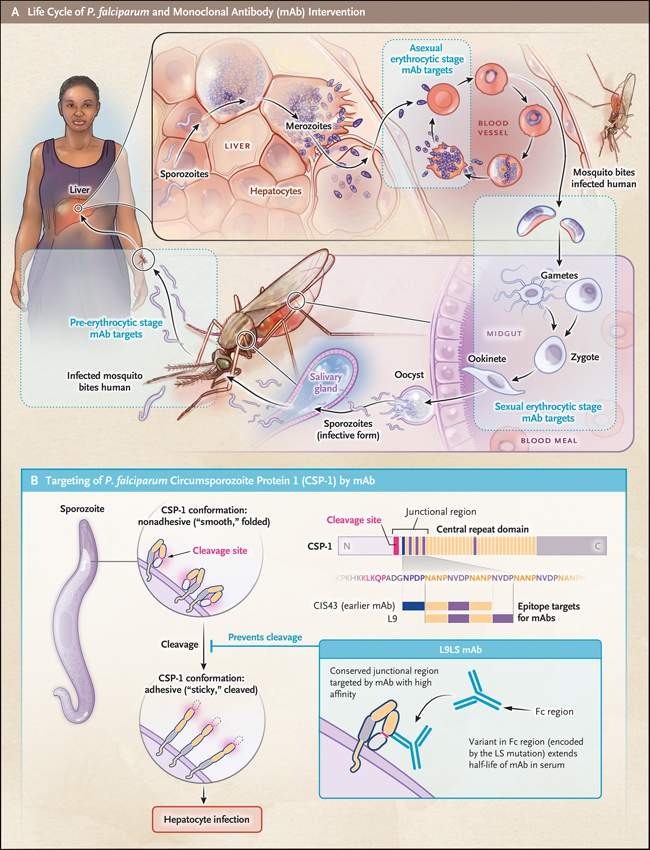
Figura 1: rompiendo el ciclo de vida del Plasmodium falciparum.
En la etapa preeritrocítica, el objetivo de elección es la proteína 1 del circumsporozoito (CSP-1), llamada así porque es la predominante en el esporozoito. Es la diana de la vacuna contra la malaria RTS,S/AS01 (Mosquirix, GSK), por lo que está clínicamente validada. El anticuerpo utilizado en un ensayo realizado recientemente (Low-dose subcutaneous or intravenous monoclonal antibody to prevent malaria. N Engl J Med 2022;387:397-407), el L9LS, se dirige a una parte específica de un epítopo de unión altamente conservado en CSP-1 y parece ser al menos tres veces más potente que los anticuerpos anti-CSP-1 anteriores (un epítopo es la parte de la molécula a la que se une el anticuerpo).
CSP-1 es un atractivo objetivo porque es la principal proteína del esporozoíto, y solo hay un puñado de ellos durante un solo ciclo de infección. Además, son accesibles en las primeras etapas de la infección.
CSP-1 tiene dos estados conformacionales: suave y adhesivo. En el primero, la proteína se pliega de tal manera que un extremo impide el acceso a una región "pegajosa" en el otro extremo que se cree que media en la adhesión a los hepatocitos humanos; esta adhesión es necesaria para la infección de los hepatocitos. Los esporozoitos migratorios tienen esta conformación suave. En el segundo, la región pegajosa queda expuesta. La escisión de la proteína CSP-1 convierte a la CSP-1 de la conformación suave a la conformación adhesiva, requerida para la invasión de los hepatocitos por los esporozoitos. Si se evita la escisión, no puede ocurrir la infección de los hepatocitos. El anticuerpo L9LS se une a un epítopo de unión único de CSP-1 cuando está en la conformación suave, evitando la escisión y, por lo tanto, la formación de la conformación adhesiva.
L9LS tiene dos ventajas sobre otros anticuerpos. La primera es que se dirige a una región más estrechamente definida de la proteína CSP-1, con alta afinidad. Estas propiedades lo hacen tres veces más potente que los anticuerpos anti-CSP-1 anteriores.
La segunda ventaja es que el anticuerpo L9LS alberga una "característica de diseño" clave (codificada por la mutación LS) que aumenta el receptor Fc neonatal, así se abre en una nueva pestaña vinculante, que, a su vez, protege el anticuerpo de la degradación celular y, por lo tanto, aumenta su vida media en la sangre en un factor de casi tres, de 21 días a 56 días. El uso de anticuerpos monoclonales que mantienen un alto nivel de protección durante un período prolongado (de 3 a 6 meses) es un prometedor enfoque para proteger a las poblaciones vulnerables, como los niños, quienes idealmente deberían recibir una inyección de L9LS solo una vez por temporada o una vez al año.
Hay dos estrategias ampliamente utilizadas para la protección contra la infección por malaria. La primera es el uso de métodos de control de vectores para prevenir el contacto inicial del mosquito infectado con los humanos. Estos incluyen mosquiteros tratados con insecticida y larvicidas.
La segunda es la quimioprevención con fármacos de molécula pequeña, aquí se da una nueva posibilidad. Los turistas y otros viajeros generalmente reciben un curso diario de la combinación de fármacos antipalúdicos atovacuona-proguanil, que ataca el crecimiento del parásito dentro de los eritrocitos y es altamente efectivo. Sin embargo, es caro y está limitado a un régimen de 60 días, por lo que no es adecuado su uso prolongado. Los ciclos mensuales de un régimen combinado, sulfadoxina-pirimetamina más amodiaquina, se han utilizado ampliamente para la quimioprevención de la malaria estacional en niños africanos menores de 5 años y son recomendados por la OMS. Estos medicamentos son seguros, disponibles y económicos (el costo es de $1 por niño por temporada) y reducen el riesgo de paludismo clínico en casi un 75 % (tasa de riesgo, 0,27; intervalo de confianza del 95 %, 0,25 a 0,29). Existen programas de quimioprevención similares para mujeres embarazadas y cada año se administran más de 60 millones de esquemas mensuales. Esta eficacia ha ayudado a centrar la eficacia para las nuevas intervenciones, y se ha establecido una reducción mínima del riesgo de aproximadamente el 80%.
El pasado mes de octubre, tras revisar extensos estudios de seguridad de fase 4, la OMS recomendó a RTS,S/AS01 como la primera vacuna contra la malaria causada por P. falciparum. Su eficacia contra todos los episodios de paludismo clínico fue del 39 al 50% entre los niños de 5 a 17 meses de edad, pero solo del 23 al 30% entre lactantes de 6 a 12 meses de edad. El precio de la vacuna no es definitivo, pero se asume el de unos $5 por dosis, y un programa de cuatro dosis en niños de 5 meses de edad o más elevan el costo total a $20 por niño, más los gastos de administración del programa.
La aparición de resistencia a medicamentos es la pesadilla de toda la quimioterapia antiinfecciosa, incluidos los anticuerpos monoclonales. Es importante probar la presencia de mutaciones de resistencia en el genoma de P. falciparum in vivo y observarlas clínicamente, como se hace con los medicamentos de molécula pequeña. El hecho de que el anticuerpo se dirija al esporozoíto es tranquilizador, dado que solo un puñado de esporozoítos están presentes al inicio de la infección (en comparación con billones de merozoítos) y no experimentan división sexual. El uso de terapias combinadas es un enfoque tradicional para abordar la resistencia a los medicamentos. Se están desarrollando otros anticuerpos, por lo que es posible que eventualmente se llegue a una combinación de anticuerpos, similar a la del SARS-CoV-2. Dicho esto, las personas en áreas de alta transmisión de malaria son portadores asintomáticos, sus sistemas inmunológicos son tolerantes a la infección y no tienen síntomas evidentes, por lo que cualquier enfoque basado en anticuerpos requeriría un tratamiento farmacológico inicial para eliminar el reservorio de parásitos en tales personas.
La efectividad y el costo de cualquier estrategia son factores clave a considerar. La investigación concluye que la protección con L9LS se alcanzó a una concentración sérica de 9,2 μg por mililitro. La ruta de entrega también es importante. El ensayo incluyó la administración intravenosa, que es apropiada en un entorno experimental, pero de uso cuestionable en el campo. El volumen total máximo de inyección intramuscular o subcutánea es de 1 ml en lactantes y, dada la solubilidad y viscosidad del anticuerpo, la dosis total en 1 ml sería de aproximadamente 100 mg. El valor de producción de anticuerpos obviamente depende de los anticuerpos individuales, pero las estimaciones de $50 por gramo de anticuerpo son ciertamente factibles. Estas aproximaciones sugieren que estos anticuerpos podrían estar en un rango de precio similar al de las actuales vacunas, pero con el potencial de ser menos costosos a medida que se desarrolle la tecnología.
Será importante evaluar el nivel de protección conferido por L9LS en niños de África. El análisis de combinaciones de enfoques será fundamental, como probar el anticuerpo en combinación con las intervenciones actuales de quimioprevención y, potencialmente, con la vacuna.
Fuente bibliográfica
Monoclonal Antibodies for Malaria
Timothy Wells, Sc.D., and Cristina Donini, Pharm.D., Ph.D.
Medicines for Malaria Venture, Geneva.
N Engl J Med 2022; 387:462-465