Envejecer sin cancer con el último guardián del genoma
INTRODUCCIÓN
En el campo de la investigación oncológica, el gen p53 es el principal objetivo de atención y trabajo. Se encuentra en el brazo corto del cromosoma 17 (17p13) y codifica una proteína nuclear de 53 KDa, de ahí su nombre. Este gen es la mejor y más potente defensa anticancerosa, y prueba de ello, es que una buena parte de los tumores surgen y se convierten en malignos únicamente si p53 ha sido previamente inactivado por algún accidente molecular, mutación u otro proceso. Se sabe que la función más destacada de su proteína es la de detectar diversas alteraciones que puedan ocurrir en el ADN de los cromosomas de las células, tales como las roturas en las cadenas del ácido nucleico, o las modificaciones químicas aberrantes. La primera respuesta de p53 a estas alteraciones es inducir la muerte celular e impedir entonces la multiplicación de las células para evitar así la propagación de unidades defectuosas. En algunos casos, también es capaz de corregir errores. Esta propiedad ha señalado a este gen como el último “guardián del genoma”.
El cáncer es una compleja mezcla de alteraciones y errores genéticos, en donde frecuentemente p53 se encuentra alterado, pero pese a que una neoplasia se ha desarrollado en ausencia del gen defensor, las células tumorales siguen “recordando” que deben de detener su crecimiento o morir cuando p53 vuelve estar activo. Como resulta imposible introducir el gen de forma artificial para eliminar los tumores, la estrategia es “despertarlo” con un fármaco dirigido a las células cancerígenas para reestablecer su función. Los diferentes grupos científicos han empleado diversas variantes genéticas en modelos animales para demostrar que es posible resucitar su misión, permitiendo que el tumor desaparezca por completo, o al menos en gran parte.
Dos formas de “matar”: los resultados de los estudios realizados en ratones modificados genéticamente señalan que la activación de p53 no causa la muerte de las células cancerígenas, ya que en determinados tumores, las células no mueren sino que entran en senescencia, es decir, pierden su capacidad de multiplicarse. Las células tumorales se mantienen con vida, aunque quedan “congeladas”. El sistema inmune hace el resto del trabajo para eliminar el tumor. En ratones con linfomas la reactivación del gen logra que los tejidos malignos mueran en un par de días. Sin embargo, en los sarcomas las células dejan de crecer y entran en senescencia.
Aquí, se sostiene, se abre otra vía de tratamiento: fármacos que no sólo busquen la muerte celular sino la senescencia, un freno innato del organismo a la progresión de lesiones premalignas.
Regresión cancerígena y longevidad
Tres recientes informes han demostrado que los cánceres en ratones pueden ser eliminados con la activación de un solo gen, el Tp53, que codifica la proteína p53. Se ha sospechado por décadas sobre el poder de p53 con respecto a la eliminación de células cancerígenas, pero la supresión de tumores malignos mediante su activación no se había observado.
La proteína p53 es indiscutiblemente el más importante sensor de estrés que los mamíferos poseen. Bajo condiciones normales, y básicas, este prótido es muy inestable, debido a la rapidez de su degradación. Pero ante cualquier tipo de estrés, incluyendo señales oncogénicas y daño al ADN, se detiene la degradación y se efectúa su activación. La P53 activada gatilla un complejo programa transcripcional en las células estresadas que puede terminar en su eliminación a través de la apoptosis o senectud.
Los tumores son ambientes con condiciones altamente estresantes que imponen una fuerte presión para eliminar el sistema de salvaguardia mediado por p53. Prácticamente todos los cánceres humanos “aplican” algún tipo de debilitación sobre las vías de p53: cerca del 50% posee mutaciones o una deleción en TP53. El otro 50% conserva la función del gen pero la tiene minimizada a través de su degradación, inhibiendo los acontecimientos que activan el gen, o alterando los efectos de p53 al aumentar los niveles de activadores del ciclo celular o de las proteínas antiapoptóticas. Existen por lo tanto, una variada gama de esfuerzos para encontrar medicamentos que aumenten la actividad de p53 dentro tales tumores. Xue y colaboradores (Nature 2007; 445:656-60), Ventura y colaboradores (Nature 2007; 445:661-5) y Martins y colaboradores (Cell 2006; 127:1323-34), reportaron los resultados de experimentos en modelos de ratón para el cáncer (específicamente hepatocarcinoma, linfoma y sarcoma) en que p53 puede activarse-inactivarse por intervalos mediante el empleo de estímulos exógenos (eso sí, sin aplicación clínica). Los investigadores por lo tanto pudieron inducir cánceres con un gen p53 silencioso; posteriormente y después de que los tumores se habían desarrollado y crecido, “giraron” la expresión de p53.
Los grupos de W. Xue y A. Ventura observaron que p53 podía eliminar con eficacia los tres tipos de cáncer. Los resultados fueron espectaculares: en algunos casos, la regresión casi completa (tamaños monitoreados por imagen de resonancia magnética y otras técnicas de proyección de imagen) se alcanzaba apenas 2 días después de la activación de p53. En otros casos, la supresión tumoral tardaba unos 10 días.
Por otra parte, la unidad de Carla P. Martins utilizó un sistema levemente diferente. Trasplantaron células de linfoma con el gen Myc en ratones tipo salvaje alterando la expresión de p53 en dichas células. Este linfoma (Myc) es una enfermedad particularmente agresiva similar al linfoma de Burkitt (patología que resulta de la translocación cromosómica que afecta al gen Myc, que cambia el patrón de expresión y altera su función natural de control en el crecimiento y proliferación celular), así que el desarrollo tumoral se retrasó o detuvo en los ratones tratados. Los linfomas “adormecidos” carecían del gen Arf, que codifica un activador de p53 y se expresa en respuesta al estrés o al mismo Tp53, indicando que la actividad p53 es incompatible con el crecimiento tumoral.
La alteración de p53 no tuvo ningún efecto en los tejidos de ratones normales; estas células carentes de señales de estrés (presentes en los tumores) activaban y estabilizaban a p53. Este hecho también sugiere que una terapia génica puede tener pocos o mínimos efectos indeseados sobre el organismo.
Estos estudios de W. Xue, A. Ventura y C. P. Martins, que son impresionantes, deben ser interpretados con precaución. Los resultados se obtuvieron en ratones en los cuales los tumores se desarrollaban en completa ausencia de p53, y esta presión selectiva desensibilizaba los activadores o efectores de p53. En cambio, en los cánceres humanos p53 se conserva intacto ya que generalmente sólo se alteran las vías de la proteína. Por esta razón, la reactivación del gen con un medicamento ocurriría en un ambiente celular capaz de ser resistente al efecto de p53. Esto no significa que tal terapia sea ineficaz, pero sería inverosímil emplear los métodos usados por estos investigadores. Quizás, la sorpresa más grande proporcionada por los tres estudios fue el descubrimiento de la senectud como un mecanismo primario de regresión tumoral (figura 1).
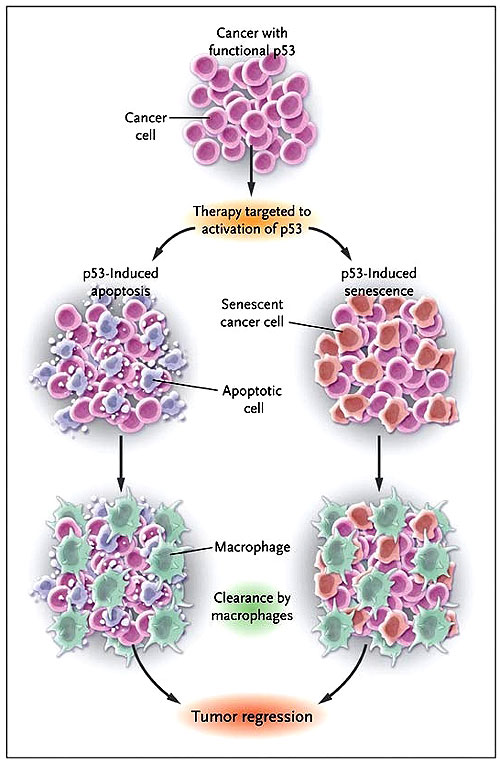
Un cáncer con la proteína funcional puede responder a una terapia basada en p53 mediante apoptosis o senescencia. Las células apoptóticas y senescentes son reconocidas y fagocitadas por los macrófagos, dando por resultado la eliminación del tumor.
En el caso de los linfomas inducidos por radiación, la regresión ocurre rápidamente y está asociada a una fuerte apoptosis. En cambio, los hepatocarcinomas y los sarcomas se retraen más lentamente que los linfomas y no se ha demostrado ninguna forma de muerte celular programada. Esto resultados inspiraron a los investigadores a determinar si p53 sería capaz de inducir senectud tumoral. Como la apoptosis, el envejecimiento es una respuesta frente al estrés, pero en vez de inducida la muerte de las células, pone un freno permanente a la proliferación celular. Esto está bien establecido en los tumores premalignos, pero en los no malignos existe una gran proporción de células senescentes. Este hecho es consistente con el concepto que los tumores son ambientes muy estresantes y esa senectud puede ser un eficiente freno en la progresión del tumor. Xue y colaboradores investigaron las bases para la regresión de tumores senescentes y observaron que ellos se vuelven a transformar al ser infiltrados por neutrófilos, macrófagos y células asesinas naturales que eventualmente destruyen las células y la vasculatura tumoral. Esta consecuencia indica un mecanismo alternativo a la muerte celular que también podría explicar la regresión de un cáncer. Estos tres estudios apoyan fuertemente la búsqueda de terapias dianas basadas en la activación de p53 y señalan que la senescencia, además de la muerte celular, es un objetivo relevante para futuras terapias anticáncer.
Fuente bibliográfica
Cancer regression by senescence.
Manuel Serrano, Ph.D.
Spanish National Cancer Research Center, Madrid.
N Engl J Med. 2007 May 10; 356(19):1996-7