Enfermedades y sus mecanismos
Corazón que falla, motor sin combustible
INTRODUCCIÓN
La insuficiencia cardíaca representa una enorme carga médica y social. Es una enfermedad relativamente común: más del 2% de la población de los Estados Unidos está afectada, unos 5 millones de personas, y entre el 30 al 40% de los pacientes mueren de un paro cardíaco en el plazo de un año después de recibir el diagnóstico. La insuficiencia cardíaca inhabilita y reduce seriamente la calidad de vida de un individuo. Consume aproximadamente un dos por ciento del presupuesto del servicio de salud del Reino Unido, y en Norteamérica, el coste del tratamiento anual total para la enfermedad ronda los 28 mil millones de dólares. Por otra parte, los valores aumentarán durante los años debido al envejecimiento de la población y a los mejores tratamientos.
Durante los últimos 20 años, ha habido un considerable progreso en el manejo de la insuficiencia cardíaca con los inhibidores de la enzima convertidora de la angiotensina (ECA), los antagonistas de la aldosterona, los betabloqueadores y con la terapia de resincronización. A pesar del acceso a mejores y modernos esquemas, sin embargo, la condición todavía se asocia a un índice de mortalidad anual del 10%. La búsqueda de mejores tratamientos es uno de los principales desafíos para la cardiología.
La insuficiencia cardíaca crónica es multifactorial. Existen muchas razones por las que un corazón humano puede fallar, pero la evidencia disponible sugiere que la deficiencia se debe a la carencia de combustible, donde la alteración energética juega un papel importante en los mecanismos del infarto. Por esta razón, la modulación del metabolismo cardíaco promete un nuevo acercamiento al tratamiento de la patología.
Esta revisión describe el metabolismo energético del corazón, valora los métodos usados para su evaluación, analiza el papel del metabolismo energético deteriorado y da opciones para una terapia metabólica.
La hipótesis de la falta de energía
El concepto que el corazón deficiente es un motor carente de energía se ha mantenido durante décadas. Fue propuesto en 1939 por Herrmann y Decherd, que, en su artículo titulado “la naturaleza química de la insuficiencia cardíaca”, describió concentraciones notoriamente bajas de creatina en el miocardio. Para los grupos de investigación más importantes e influyentes, el metabolismo energético del corazón es un tema de considerable interés. Una razón importante de este asunto es que cualquier tratamiento que optimice la disponibilidad energética mejorará considerablemente el pronóstico. La afección crónica se ha comparado a un caballo débil y cansado, y si este animal se alimenta correctamente, puede recuperarse y trabajar a largo plazo, aunque sea a un menor nivel.
Metabolismo energético cardíaco
La privación de la energía cardíaca tiene un papel fundamental en la insuficiencia cardíaca. El corazón consume más energía que cualquier otro órgano, cada ciclo de 24 horas quema 6 kilogramos de ATP, 20 a 30 veces su propio peso. Por día, late cerca de 100.000 veces y bombea aproximadamente 10 toneladas de sangre a través del cuerpo. Para adquirir la energía necesaria para realizar su función, convierte la energía química almacenada en los ácidos grasos y en la glucosa en energía mecánica. La falta de una cantidad energética adecuada causa la falla mecánica del corazón.
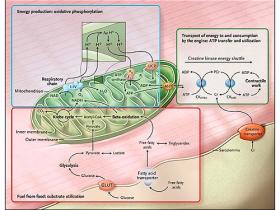
El metabolismo energético cardíaco es complejo (figura 1). La maquinaria metabólica tiene tres componentes principales. El primero es la utilización del sustrato: uso de energía proveniente de los alimentos. Este proceso exige la recaptación celular de ácidos grasos y glucosa libre, la metabolización de estos mediante beta-oxidación y glicólisis, y la entrada de los metabolitos intermediarios que resultan del ciclo de Krebs. El segundo componente es la fosforilación oxidativa: la producción de energía por la cadena respiratoria mitocondrial. La fosforilación del ADP por este mecanismo produce ATP altamente energético, que es fuente directa de energía para todos los procesos cardíacos. El tercer factor es la transferencia y utilización: el transporte de ATP hacia el motor corazón (las miofibrillas) y su posterior consumo.
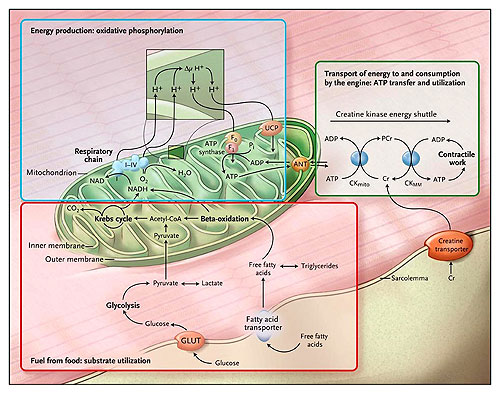
El metabolismo energético en el corazón tiene tres componentes. La utilización del sustrato, la fosforilación oxidativa y la producción de energía, y finalmente, la transferencia y utilización de la energía.
En particular, en el tercer componente del metabolismo energético cardíaco (transferencia y utilización del ATP), la creatina quinasa mitocondrial cataliza la fosforilación del ADP por el fosfato de creatina, obteniéndose creatina (en forma de fosfocreatina) y ATP. La fosfocreatina, una molécula más pequeña que el ATP, rápidamente difunde desde la mitocondria a las miofibrillas, donde la creatinina quinasa miofibrilar cataliza la reformación de ATP a partir de la fosfocreatina. La creatina libre, formada por el retiro del fosfato, difunde nuevamente a las mitocondrias. La creatina es producida por el hígado y los riñones y transportada al corazón, donde es tomada por un transportador específico ubicado en la membrana plasmática a través de una gradiente de concentración 50 veces superior. Una pequeña cantidad de creatina se pierde por difusión pasiva a través del sarcolema. Una función importante del sistema creatina quinasa es actuar como almacenador intermediario de energía. Cuando la demanda energética se dispara, el nivel de fosfocreatina cae, guardando el ATP en un nivel normal, pero elevando las concentraciones de ADP libre. Lamentablemente, el aumento de ADP inhibe la función de muchas enzimas intracelulares, causando la falla del mecanismo de contracción del corazón.
Todos los factores energéticos del corazón pueden ser medidos mediante el uso de métodos estándares en tejidos de miocardio obtenidos durante una biopsia o a la hora del trasplante o en tejido cardíaco de animales. Sin embargo, el análisis del ATP y de la fosfocreatina en muestras de tejidos es problemático, debido a la inestabilidad de estas moléculas. Por esta razón, el principal método para analizar el ATP y la fosfocreatina es la espectroscopia por resonancia magnética fósforo-31 (31P-MR), figuras 2A, 2B y 2C.
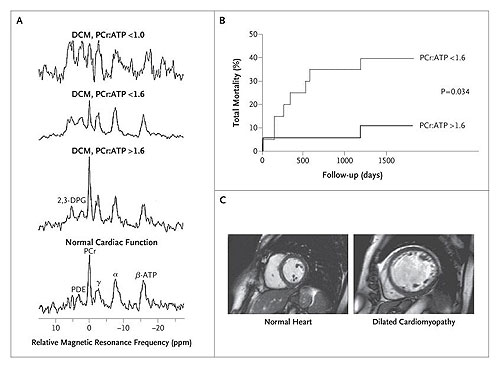
El panel A muestra espectroscopias de corazón (desde abajo hacia arriba) en un individuo sano, un paciente con cardiomiopatía dilatada (DCM) y relación normal de fosfocreatina (PCr)-ATP (>1.6; 1.6 era el promedio), un paciente con DCM y relación reducida de PCr-ATP (<1.6), y un paciente con DCM y relación severamente reducida de PCr-ATP (<1.0). El paciente con el cociente seriamente reducido murió 7 días después de someterse al examen de resonancia magnética. 2,3-DPG denota 2,3-difosfoglicerato, PDE fosfodiésteres, y gamma, alfa y beta los átomos de fósforo del ATP. El panel B muestra un análisis de mortalidad en dos grupos de pacientes con DCM: uno con una relación alta de PCr-ATP y otro con un cociente más bajo. Los pacientes con un cociente inicialmente bajo presentaron una mayor tasa de mortalidad durante el período de estudio (seguimiento promedio, 2.5 años). Finalmente, el panel C representa un corazón normal y un corazón extremadamente dilatado.
Trastorno del metabolismo energético
Los cambios en el metabolismo energético cardíaco en la insuficiencia cardíaca se muestran en la figura 3, que resume los resultados en modelos animales y estudios clínicos. Las alteraciones ocurren en los tres componentes del metabolismo energético del corazón: sustrato, fosforilación oxidativa y metabolismo del fosfato.
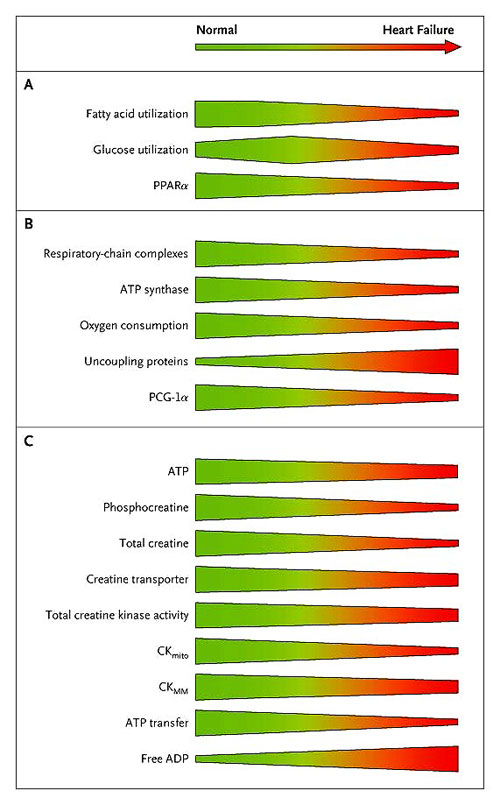
En pacientes con insuficiencia cardíaca, los cambios en el uso del sustrato (panel A) incluyen una regulación al alza inicial con la subsiguiente reducción de la utilización de la glucosa y un bajo consumo de ácidos grasos, en parte mediado por la regulación hacia abajo del receptor alfa del activador-proliferador del peroxisoma (PPAR-alfa). Las alteraciones en la fosforilación oxidativa (panel B) se caracterizan por la caída de la producción energética, con reducciones en el consumo de oxígeno y menor actividad de la ATP sintasa y de la cadena respiratoria, debido a la regulación hacia abajo de lcoactivador PPAR-alfa 1-alfa (PGC-1-alfa). Los cambios en el metabolismo del fosfato (panel C) incluyen un fuerte deterioro del metabolismo de la creatina quinasa, mayores concentraciones de ADP, y, en la insuficiencia cardíaca avanzada, menores niveles de ATP.
Reguladores moleculares del metabolismo energético
Las demandas energéticas del corazón varían ampliamente durante el desarrollo cardíaco y con el estrés fisiológico o anormal. La generación energética debe ir unida a la demanda energética, pero el corazón tiene poca capacidad para almacenar sustrato. Sin embargo, existen mecanismos que inducen la expresión de genes que codifican los reguladores moleculares del metabolismo energético.
Varios factores transcripcionales específicos son activados por metabolitos lipídicos de forma análoga a la activación de receptores nucleares por las hormonas esteroides. Estos factores de transcripción rápidamente interactúan con la expresión génica cambiando el entorno de los sustratos, y ellos normalmente requieren de proteínas coactivadoras para su acción. Entre estos factores, están los receptores nucleares de la familia PPAR (siglas inglesas para receptor de la activación de la proliferización en el peroxisoma), que abarcan tres isoformas: PPAR-alfa, PPAR-beta y PPAR-gamma. Los tres afectan el metabolismo lipídico cardíaco, aunque el principal regulador parece ser PPAR-alfa, quien controla la expresión de las enzimas implicadas en la oxidación de los ácidos grasos. En la hipertrofia cardíaca, la expresión de PPAR-alfa está disminuida en proporción con la baja utilización de los ácidos grasos, cambio típico del corazón hipertrofiado.
A pesar de estos avances, se necesita de investigación adicional para entender completamente si la alteración en las señales metabólicas se debe a procesos adaptativos, no adaptativos, o a ambos (dependiendo de la fase de la insuficiencia). Además, se desconoce la influencia de los reguladores moleculares en el transporte de la creatina y en la expresión de la creatina quinasa en la insuficiencia cardíaca.
Modelos genéticos experimentales de pérdida funcional
El papel causal de la alteración energética en la insuficiencia cardíaca ha sido tema polémico por décadas, y la controversia aún no se resuelve. Para obtener respuestas definitivas se realizan estudios con ratones manipulados genéticamente a través de los modelos denominados “knock-out” (pérdida de función), que permiten evaluar los componentes genéticos de la maquinaria metabólica o los errores de metabolismo en seres humanos. La tabla 1 enumera las anormalidades genéticas que se han estudiado tanto en animales como en humanos, junto con el correspondiente fenotipo cardiaco metabólico y funcional. La disfunción de una variedad de genes que codifican para los componentes metabólicos específicos relacionados con la utilización del sustrato, la oxidación oxidativa y el metabolismo del fosfato causa una pérdida de la reserva contráctil, insuficiencia cardíaca, hipertrofia, taquiarritmias o braditaquiarritmias. Estos estudios genéticos demuestran que la integración total de la máquina metabólica es importante para el desempeño normal de la función cardiaca y esta ablación selectiva de los componentes metabolismos energéticos puede causar una insuficiencia cardíaca temprana o avanzada.
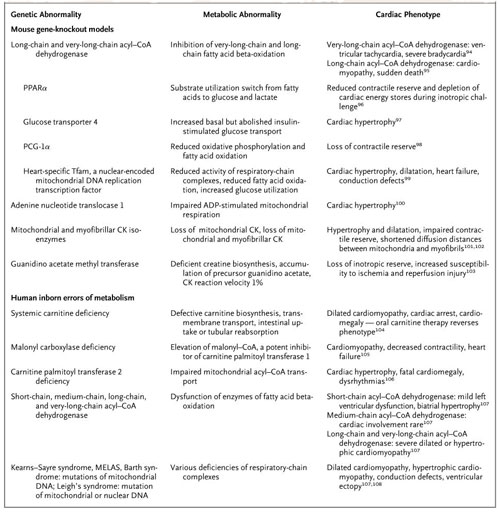
Muchas de estas deficiencias y síndromes también tienen manifestaciones extracardiacas que no se detallan aquí. CoA denota a la coenzima A, CK a la creatina quinasa y síndrome MELAS a encefalomiopatía mitocondrial, acidosis láctica y accidentes cerebrovasculares.
Implicaciones en el tratamiento de la insuficiencia cardíaca
Los inhibidores de la ECA, los diuréticos y los betabloqueadores pueden tener efectos metabólicos indirectos en el corazón, pero no afectan directamente el metabolismo energético. ¿En pacientes con patología cardíaca podría el metabolismo energético ser un objetivo específico para futuras terapia?
Una estrategia convincente para la intervención metabólica en la insuficiencia cardíaca es modular la utilización del substrato. En un estudio de ocho pacientes enfermos, la infusión intracoronaria de piruvato mejoró la función cardiaca en breve plazo, y en modelos animales, un aumento en la utilización de glucosa mediante el péptido 1 tipo glucagón mejoró la función ventricular izquierda. La manipulación directa del substrato es factible con el uso de inhibidores parciales de la oxidación de los ácidos grasos o de inhibidores de la carnitina palmitoil transferasa 1. Estos compuestos tienen formas complejas de acción, pero todos inhiben parcialmente la utilización de ácidos grasos y promueven la utilización el uso de la glucosa. Se desconoce si la supresión de la oxidación grasa es beneficiosa o perjudicial en la insuficiencia cardíaca, y la causa o la etapa de la insuficiencia cardíaca pueden dictar el resultado de esta clase de tratamiento.
Una segunda estrategia es la estimulación directa de la fosforilación oxidativa, Sin embargo, actualmente no existen estimuladores eficaces del proceso, aunque se ha observado que el incremento de la actividad de PCG-1alfa y el consiguiente estímulo de las enzimas que participan en la fosforilación oxidativa puede ser un acercamiento prometedor. Una alternativa sería reducir los niveles de ácidos grasos libres, permitiendo reprimir las proteínas mitocondriales, de tal modo que aumente la síntesis de ATP.
Por último, y como tercera posibilidad para la intervención metabólica, está la manipulación directa del fosfato altamente energético, su disponibilidad o la eficacia de su utilización. Los niveles de creatina y fosfocreatina pueden ser elevados mediante una función más activa del transportador de creatina, aunque aumentos masivos del transportador podrían ser dañinos, ya que podrían dispararse las concentraciones de ADP. Futuros estudios demostrarán si revertir la caída de la creatina y de la fosfocreatina mediante el control de la actividad del transportador sería beneficioso en la insuficiencia cardíaca. Esto podría ser factible al optimizar la eficacia miofibrilar del ATP con la sensibilización al calcio o por compuestos que activen la miosina.
Conclusiones
La terapia metabólica es un prometedor camino para el manejo de la insuficiencia cardiaca, y los objetivos idóneos son la utilización del sustrato, la fosforilación oxidativa y la disponibilidad del fosfato. Es necesario un esfuerzo multipropósito y en conjunto para investigar adecuadamente este concepto. Futuros estudios experimentales, por ejemplo, deberían clarificar los mecanismos que conducen al descontrol energético y sugerir nuevos blancos moleculares para la intervención terapéutica. Los futuros ensayos pueden utilizar la relación fosfocreatina-ATP del miocardio para monitorear la respuesta energética del corazón a la terapia metabólica, y generar un marcador de efectos pronósticos a largo plazo. Finalmente, las investigaciones tendrán que probar o refutar la eficacia clínica de los moduladores metabólicos. Existe la esperanza que tal esfuerzo combinado conducirá a nuevas terapias que mejoren los síntomas, el pronóstico y la calidad de vida de los pacientes con insuficiencia cardiaca crónica.
Fuente bibliográfica
The failing heart--an engine out of fuel
Stefan Neubauer, M.D., F.R.C.P.
Department of Cardiovascular Medicine, University of Oxford and John Radcliffe Hospital, Oxford, United Kingdom. stefan.neubauer@cardiov.ox.ac.uk
N Engl J Med. 2007 Mar 15;356(11):1140-51