Telómeros, telomerasa, cáncer y envejecimiento
INTRUCCIÓN
A las estructuras cromatínicas especializadas localizadas en los extremos de los cromosomas eucariontes se les denomina telómeros. Tanto el ADN como las proteínas que los constituyen presentan características singulares que los diferencian del resto del cromosoma. La medicina contemporánea está convencida de que las claves de algunas patologías y el envejecimiento hay que buscarlas en el proceso de la división celular. El reloj biológico que controla la vida de todas las células es el telómero, (del griego telos, final, y meros, componente), término acuñado por Hermann J. Muller en la Universidad de Edimburgo. Parecen estar implicados en numerosas funciones celulares, especialmente las relacionadas con el control de la duración de la vida de diferentes líneas celulares. Estas estructuras se replican durante el ciclo celular gracias a la acción de enzimas denominadas telomerasas que están formadas por proteínas y ARN, y presentan un singular mecanismo. Recientemente se ha estudiado el comportamiento de la telomerasa en las células cancerosas y sus posibles aplicaciones diagnósticas y terapéuticas. Durante cada ciclo de división celular se produce un acortamiento de los telómeros, con lo que se pierden unos 50-200 nucleótidos. Ello se debe a la incapacidad de la polimerasa de ADN de replicar los extremos. La enzima es muy activa en células fetales, manteniendo un alto nivel de proliferación en ellas, pero muy poca proliferación en las células de los tejidos de adultos.
La mayoría de las células suprimen la actividad de la telomerasa tras el nacimiento pero, por el contrario, muchas células tumorales la reactivan, contribuyendo así a la proliferación de clones malignos. Se sugiere así una nueva diana para el tratamiento del cáncer, por lo que varios estudios han contemplado la posibilidad de inhibir la telomerasa para detener el crecimiento de las células tumorales. Aunque por sí sola la telomerasa no causa transformación de células normales en cancerosas, su reactivación coopera durante la carcinogénesis con mutaciones en oncogenes como ras y genes supresores como p53 y Rb. Si la expresión de p53 se anula por mutación, se produce lo que se ha denominado "la catástrofe genética", con acumulación masiva de mutaciones.
Este trabajo, realizado por el doctor Steven E. Artandi, profesor auxiliar de hematología en la Escuela Medicina de la Universidad de Stanford (Stanford, California, Estados Unidos), presenta un resumen de los principales y más recientes hallazgos sobre la estructura y las funciones de los telómeros y la acción de las telomerasas. Sin embargo, estos descubrimientos plantean nuevos enigmas por dilucidar. Entre ellos está determinar la función del ARN telomerásico en la zona que no funciona como molde y su posible participación en la catálisis enzimática. Los factores que regulan la actividad de la enzima por una parte y la longitud de los telómeros por otra. Resolver los mecanismos moleculares que vinculan los telómeros con la regulación de la proliferación celular. Por último, también es interesante y trascendental la posible aplicación de estos conocimientos para el diagnóstico y tratamiento de enfermedades proliferativas, especialmente el cáncer.
DAÑO GENÓMICO Y SU IMPLICANCIA EN PATOLOGÍA HUMANA
Los telómeros son segmentos de ADN ubicados en los extremos de un cromosoma y desde los años 30 se les reconocen especiales características protectoras. Fueron aislados por primera vez durante los setenta demostrándose que estaban compuestos por ADN repetitivo, además cuando se les transfería a los extremos de cromosomas artificiales en levadura, podrían protegerlos contra la degradación. Paralelamente, se descubrió una nueva enzima llamada telomerasa la que agregaba repeticiones del telómero a los extremos cromosómicos mediante el uso de plantillas de ARN. Este mecanismo de adición por la telomerasa soluciona el "problema de la réplica de los extremos", es decir, la inhabilidad de las ADN polimerasas convencionales para replicar completamente los extremos de los cromosomas. En levaduras, por ejemplo, la inactivación de los componentes de la enzima conduce al acortamiento del telómero y a su eventual senectud. Estos descubrimientos fundamentales en la biología celular y en los cromosomas reflejan aspectos que van más allá de los postulados científicos básicos: tienen ramificaciones para la salud humana y las enfermedades. Recientes investigaciones han demostrado que los telómeros y la telomerasa son factores centrales en la biología del cáncer, en las células madre, en el envejecimiento y en la disqueratosis congénita. La relación inicial entre la telomerasa y el cáncer se estableció cuando se observó que en la mayoría de los tumores humanos se sobre-expresaba la enzima, cosa que no ocurría en los tejidos sanos y en los cultivos de células normales. La telomerasa humana abarca dos subunidades principales: la transcriptasa reversa de la telomerasa, (TERT, por sus siglas en inglés), subunidad catalítica de la proteína, y el componente ARN de telomerasa (TERC, por sus siglas en inglés). Cuando se cultivan in vitro, muchas de las células humanas primarias carecen de suficiente TERT para mantener los telómeros. Por lo tanto, éstos se acortan progresivamente con la división celular, provocando el envejecimiento de las células, pues un subgrupo de telómeros pierde su capacidad de proteger los extremos de los cromosomas y por lo tanto la maquinaria de reparación celular reconoce al ADN como dañado o inservible (figura 1).
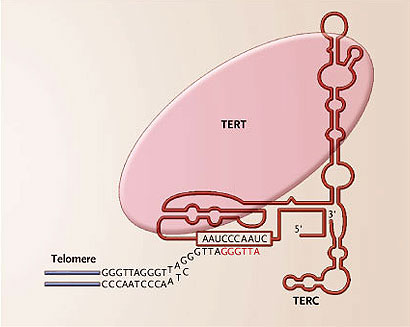
Abarca dos subunidades, transcriptasa reversa de la telomerasa (TERT) y el componente del ARN de telomerasa (TERC). La enzima agrega repeticiones teloméricas en los extremos de los cromosomas por transcripción reversa de la plantilla de TERC desde el ARN al ADN mediante incrementos de seis nucleótidos (secuencias en rojo). Puede continuar alargando telómeros a través de un mecanismo de repetitivas disociaciones del telómero nuevamente sintetizado, realineando y agregando otros seis nucleótidos a la vez. La desregulación de la enzima es crítica en el cáncer, ya que permite que las células tumorales se dividan un número ilimitado de veces.
La sobre-expresión de TERT en células humanas primarias es suficiente para prevenir el agotamiento del telómero permitiendo a las células normales proliferar indefinidamente, comportamiento evocador de las células neoplásicas en los seres humanos. De hecho, en el cáncer, la expresión de la telomerasa apenas cumple su función, dotando a las células con una infinita capacidad replicativa. En los tumores en desarrollo, se ha observado que la enzima está sobre-regulada, lo que explicaría porqué los telómeros se acortan considerablemente durante la génesis tumoral. Este acortamiento del telómero puede comprometer profundamente la estabilidad cromosómica y puede contribuir a los grandes cambios genómicos vistos en los procesos cancerígenos. Los modelos preclínicos de cánceres avanzados en los seres humanos sugieren que la inhibición de la telomerasa es una estrategia viable para controlar el crecimiento de las células neoplásicas. En tejidos de regeneración normal, las células madre y las células progenitoras expresan la enzima para mantener la función intacta del telómero, acción requerida para la homeostasis de los tejidos. En ratones, la inhabilitación de la telomerasa provoca el acortamiento crítico del telómero induciendo la muerte programada de la célula; y deteriora la división activa de los tejidos, incluyendo la médula, los testículos y el aparato gastrointestinal. El requisito para mantener la funcionalidad de la estructura telomérica podría estar relacionado con el papel esencial de los telómeros intactos en la propia renovación de las células madre, lo que se ha demostrado claramente con células hematopoyéticas en experimentos de trasplantes. Aunque la necesidad de mantener intacta la función del telómero en células madre puede explicar parcialmente el patrón de expresión de la telomerasa en tejidos humanos, recientemente se determinó que la enzima activa a las células madre a través de un mecanismo que no requiere la función típica del telómero. Por lo tanto, los telómeros y la telomerasa pueden tener profundos efectos sobre las células progenitoras en los tejidos de los mamíferos.
La pérdida gradual de las secuencias del telómero en cultivos de fibroblastos humanos sugiere una conexión con los procesos de envejecimiento. De hecho, en individuos de edad avanzada, el acortamiento del telómero se ve en muchos tejidos y a menudo se describe como un "reloj mitótico" que refleja el número de divisiones celulares que han ocurrido en la historia celular. El acortamiento crítico del telómero en tejidos humanos puede por lo tanto activar respuestas de senectud o conducir al agotamiento de la célula, lo que contribuye a un deterioro en las funciones de los tejidos en ancianos (figura 2). Más que la inutilización de las estructuras celulares dentro de un determinado tejido, los telómeros disfuncionales pueden contribuir al envejecimiento mediante interferencia funcional de las células madre. El acortamiento acelerado del telómero también acompaña al envejecimiento en las progerias tal como en el síndrome de Werner. La probabilidad de un acoplamiento causal entre el acortamiento del telómero y el envejecimiento se dilucidó por los recientes descubrimientos en la proteína de la ADN helicasa, mutada en el síndrome de Werner, la cual es necesaria para la eficiente réplica y estabilidad del telómero. Estos resultados sugieren que la disfunción del telómero pueda ser parcialmente responsable del envejecimiento prematuro considerado en el síndrome de Werner y, por extensión, en ciertos aspectos del normal envejecimiento humano.
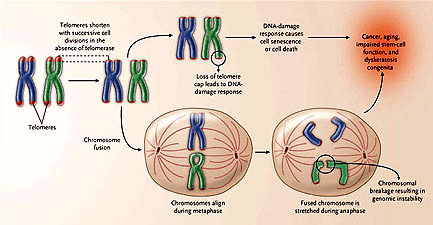
En células que carecen de telomerasa, los telómeros se acortan progresivamente con la división celular debido a la inhabilidad de la ADN polimerasa para replicar completamente los extremos de los cromosomas. Si se deteriora el casquillo protector del telómero de un cromosoma, se acciona una respuesta sobre el ADN dañado, causando la muerte celular. Alternativamente, la pérdida de protección del telómero permite que el inadecuado ensamblaje de los telómeros fusione a los cromosomas, los que son altamente vulnerables a la fractura, dando por resultado inestabilidad genómica. Ambas respuestas pueden provocar cáncer, envejecimiento, disfunción de las células madre y disqueratosis congénita.
Hoy se sabe que las mutaciones en los componentes de la telomerasa son la base de la patofisiología de la disqueratosis congénita, un síndrome heredado que se caracteriza por anemia aplástica, leucoplasia oral, distrofia de las uñas y pigmentación anormal de la piel. En su forma dominante autosómica, la disqueratosis se asocia a mutaciones en TERC o TERT. Una forma del síndrome ligada al cromosoma X es causada por mutaciones en la proteína disquerina, la cual se una a TERC y también está implicada en la biogénesis de los ribosomas. Consistente con estos descubrimientos se da el hecho de que los telómeros son más cortos en pacientes con el síndrome en comparación con personas normales. Recientemente, se ha observado que algunos pacientes con anemia aplástica pero sin otros signos de disqueratosis congénita, presentan mutaciones en TERC o TERT. Estos resultados indican que la falta de médula ósea presente en algunos pacientes con anemia aplástica y con disqueratosis congénita estaría causada por la disfunción del telómero, probablemente por la debilitación funcional de las células madre hematopoyéticas. Los nuevos descubrimientos han solventado la manera en que estos resultados relacionen a los telómeros y la telomerasa con algunas enfermedades humanas. Indudablemente, en un futuro próximo se dilucidarán los vínculos adicionales entre el telómero, su enzima y la biología humana. El conocimiento de estas relaciones conducirá a las mejoras en el tratamiento del cáncer y de otros desórdenes asociados al envejecimiento.
Fuente bibliográfica
Telomeres, Telomerase, and Human Disease
Steven E. Artandi, M.D., Ph.D.
Stanford University School of Medicine, Stanford, CA, USA
N Engl J Med. 2006 Sep 21; 355(12):1195-1197