Mecanismos patológicos
Chaperonas, estrés celular y enfermedad
INTRODUCCIÓN
Las chaperonas moleculares están implicadas en una amplia variedad de procesos celulares esenciales en las células donde se encuentran. Un subconjunto ha sido descrito inicialmente como “proteínas de golpe de calor” las cuales protegen a las células contra daños del estrés manteniendo las proteínas celulares en un estado funcional de plegamiento y previniéndolas de una irreversible agregación. Hoy en día es obvio que las chaperonas moleculares también se expresan constitutivamente en células implicadas en complejos procesos tales como sín-tesis proteica, transporte intracelular, modificación pos-traducción y síntesis de receptores de señales.
Incluida en las chaperonas moleculares hay una familia, la de las chaperoninas, de peso molecular cercano a 60 kDa (hsp60), que son quizás las mejor caracterizadas. Dos tipos son las que se conocen, las de origen procariota y pertenecientes a organelos citoplasmáticos (grupo I) y las provenientes de arqueobac-terias y en el citosol de eucariotas (grupo II). Ambos tipos de comparten una arquitectura muy parecida pero poseen importantes diferencias en el mecanismo de funcionamiento, en los cambios estructurales que se producen durante aquél y en las proteínas a las que asisten en su plegamiento.
Desde el punto de vista médico, no es sorprendente que las chaperonas moleculares estén implicadas en la patogénesis de muchas enfermedades relevantes pudiéndose mirar como potenciales objetivos farmacológicos. Comenzando con el análisis del modo de la acción molecular para seguir a nivel celular y orgánico, este interesante artículo describe los aspectos especí-ficos donde la modulación de la acción de las chaperonas debería ser de interés farmacológico y terapéutico.
Los autores de la revisión son investigadores del Centro Wadsworth, División de Medicina Molecular, Departamento de la Salud del Estado de Nueva York (A.J.L.M., E.C.M.), y del Departamento de Ciencias Biomédicas, Escuela de Salud Pú-blica, Universidad de Nueva York. Ambos docentes tienen casi un centenar de publicaciones, analizando desde el año 2002 los desórdenes patológicos y el envejecimiento con las “proteinopatías”.
INTRODUCCIÓN
Las células mantienen un completo sistema de proteínas funcionalmente competentes que hacen frente a lesiones o procesos estresantes a través del uso de varios mecanismos, que incluyen el complejo conjunto de proteínas denominadas chaperonas moleculares. La típica función de un chaperona recae en asistir a una naciente cadena polipeptídica para lograr una conformación funcional como proteína nueva y después apoyar la llegada de dicha proteína al sitio celular en donde realizará sus funciones.
Se ha incrementado el conocimiento respecto a que la inte-rrupción de los mecanismos relacionados con las chaperonas contribuye al envejecimiento y a enfermedades. Esta revisión repasa la implicación de las chaperonas defectuosas en la vejez y en varias patologías. Puesto que estas proteínas son ubicuas (presente a un mismo tiempo en todas partes), sus deficiencias y defectos pueden afectar diversos tejidos, por lo tanto, es de gran interés en medicina interna, oftalmo-logía, neurología, inmunología, endocrinología, pediatría y gerontología.
CONTROL DE CALIDAD DE LAS PROTEÍNAS Y MECANISMOS ANTIESTRES
Los diferentes tipos de estrés causan modificaciones del entorno intracelular produciendo daño al ADN y a las proteínas (Biológicos: infección, inflamación, fiebre; Psicológicos: conflictos emocionales, desbalance hormonal; Osmóticos: cambios en la concentraciones de sal, azúcar y otros osmolitos, Físicos: calor, frío, varios tipos de radiación que incluyen ultravioleta y campos magnéticos). También inducen respuestas a la presión; lo cual inhibe muchos genes de control interno y activa otros de descontrol, que normalmente no se transcriben o lo hacen a niveles bajos en ausencia de estrés. Consecuentemente, la concentración intracelular de proteínas perjudiciales aumenta, elevando consecuentemente las concentraciones de chaperonas.
El estrés celular también causa desnaturalización de las proteínas: la molécula pierde su conformación funcional nativa. Los chaperonas ayudan a la molécula dañada para recuperar su conformación funcional cuando está desplegada o desdoblada. Si procede el efecto negativo de la presión celular, las proteínas intracelulares se desnaturalizan y pasan a ser insolubles. Estas moléculas desnaturalizadas tienden a unirse unas a otras, precipitan, y forman cuerpos de inclusión. El desarrollo de estos cuerpos es un proceso patológico común en las enfermedades de Parkinson, Alzheimer y Huntington, uniformes en ausencia de estrés. Las proteínas desnaturalizadas y agregadas no pueden funcionar y deben ser rescatadas o eliminadas con la ayuda de las chaperonas.
La figura 1 nos muestra qué sucedería si una mutación se da en una chaperona. Se produce una estructura defectuosa e incapaz de funcionar (defecto genético) o si la modificación post transcripcional es aberrante (defecto adquirido). Una alteración genética o adquirida puede afectar uno o más dominios especializados de la proteína. Las manifestaciones de una “chaperonopatía” dependen del dominio o función deteriorada o suprimida.
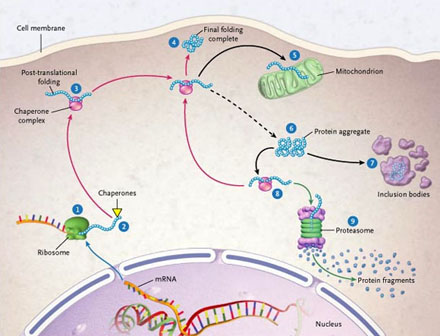
La traducción del ARN mensajero (ARNm) ocurre en el ribosoma (1). El plegamiento del polipéptido naciente comienza, asistido por las chaperonas (2). El polipéptido procede al plegamiento post translación (3). La nueva proteína se dobla correctamente en su estructura terciaria (4). Algunas proteínas se desplazan a través de organelos, tales como la mitocondria (5). Agregado de los polipéptidos no funcionales (6) y precipitados en un cuerpo de inclusión (7). Las proteínas erróneas o parcialmente desdobladas son liberadas de los agregados por las chaperonas (8) y plegadas (4) o degradadas en el proteasoma (9). Las flechas rojas denotan el camino hacia el nuevo plegamiento. Las negras señalan el camino hacia el desplegamiento y la agregación iniciada por los estresantes celulares. La indicación verde señala la degradación. El camino del paso 8 al paso 4 es muy activo en desórdenes proteicos ofreciendo un blanco conveniente para idear estrategias terapéuticas basadas en la administración de chaperonas o de genes.
Solamente una fracción de las chaperonas es codificada en genes que son inducidos por estrés perteneciendo así a la clase respectiva de proteínas. Por ejemplo, si están involucradas en mecanismos de defensa relacionados con el choque térmico, las inducidas serán denominadas proteínas de choque térmico (HSPs, por las siglas en inglés de heat-shock proteins). Las chaperonas se clasifican de acuerdo a la filogenia, estructura o masa molecular. Una chaperona no actúa sola, sino como miembro de un equipo de varias moléculas, incluyendo chaperonas y cochaperonas.
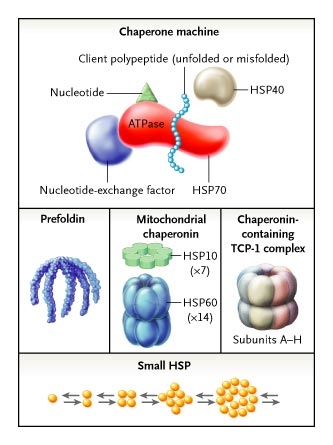
La estructura de las chaperonas corresponde a un equipo de tres proteínas: proteína de golpe de calor (HSP) 70, HSP40, y factor de intercambio nucleotídico. La HSP70 ata a un polipéptido cliente (desplegado o mal plegado) y, en colaboración con otros miembros del equipo, asiste al polipéptido para plegarlo correctamente y alcanzar así su conformación nativa. La prefoldina consiste en cinco subunidades distintas dispuestas como una medusa. La chaperonina mitocondrial consiste en dos ensambladuras multiméricas. El ensamblaje más grande tiene 14 subunidades HSP60; el más pequeño tiene 7 subunidades de HSP10. El complejo TCP-1 es similar en estructura a la chaperonina mitocondrial, pero con ocho subunidades distintas (de A a la H) por cada uno de sus dos anillos. Los pequeños HSPs son chaperonas, tales como los alfa-cristalinos, que normalmente son monómeros. En respuesta al estrés celular, forman los multímeros que participan en la protección de los polipéptidos desnaturalizados.
Por otra parte, las chaperonopatías adquiridas se asocian a modificaciones post transducción de la chaperona y llegan a ser clínicamente evidentes al final de la vida. Sin embargo, pueden comenzar en la niñez temprana o en la edad adulta joven y después progresar con el envejecimiento. Los mecanismos de modificaciones post transducción de proteínas son diversos, incluyen: oxidación de aminoácidos, deamidación, glicación, fosforilación, acetilación, nitrosilación y truncamiento de la proteína. Durante la senectud, estas modificaciones dañan muchas proteínas, incluyendo a las chaperonas. Como resultado, las chaperonas funcionalmente incompetentes no pueden ocuparse de una demanda excesiva de reparación de proteínas. En las chaperonopatías que se asocian a envejecimiento o enfermedades, las chaperonas pueden estar alteradas, aumentadas o disminuidas, o distribuidas anormalmente en los tejidos y en las células.
CHAPERONOPATÍAS ASOCIADAS CON EL ENVEJECIMIENTO Y LAS ENFERMEDADES
Por ejemplo, se ha estudiado extensamente la cantidad y distribución de la HSP70 en varias células y tejidos en lo referente a enfermedad y envejecimiento. Un golpe de calor a hepatocitos de rata aumenta los niveles de las chaperonas originando proteínas constitutivas 70 (HSC70) y HSP70. Estudios similares se han realizado con cultivos de fibroblastos de pulmón humano en etapas tempranas y tardías, con melanocitos epidérmicos y con fibroblastos de piel tomados de donantes jóvenes (27 a 44 años de edad) y viejos (78 a 92 años de edad). Los niveles de la proteína HSP70 en los fibroblastos de pulmón eran más bajos en los últimos estadios celulares que en los primeros, y el aumento de HSP70 y de su ARNm provocado por el calor era menor en células con procesos tardíos. Estos resultados fueron confirmados en cultivos de melanocitos.
Una disminución de los niveles séricos de HSP70 fue observado en una población de personas chinas entre 30 y 50 años de edad, con respecto a individuos de 25 a 30 años. Los niveles más altos fueron encontrados en personas de 25 a 30 años de edad. Asimismo, una disminución de concentraciones de HSP70 se observó en linfocitos de individuos mayores de 40 años, respecto a controles más jóvenes. Estos resultados indican que los niveles de chaperonas en la sangre son potenciales biomarcadores del estado de salud, particularmente en los ancianos. Se podría pensar, que las personas con concentraciones bajas en el suero tendrán una declinación más pronunciada de sus funciones vitales que la gente con niveles más altos.
FUTURO
El camino está abierto para las investigaciones básicas, aplicadas y clínicas dirigidas en descubrir nuevas chaperonopatías, para ampliar el conocimiento sobre lo que ya está identificado y demostrado, y la aclaración de los mecanismos por los cuales las chaperonas defectuosas contribuyen a la enfermedad. Estas proteínas están universalmente distribuidas y realizan muchas funciones diversas, entonces probablemente están implicadas en el inicio y progresión de enfermedades. Los desafíos en los próximos años serán determinar el predominio y las consecuencias médicas de las chaperonopatías, estandardizar pruebas diagnósticas y desarrollar estrategias de prevención y tratamiento.
Fuente bibliográfica
Sick chaperones, cellular stress, and disease.
Alberto J.L. Macario, M.D., and Everly Conway de Macario, Ph.D.
Wadsworth Center, Division of Molecular Medicine, New York State Department of Health, Albany, NY 12201-0509, USA.
N Engl J Med. 2005 Oct 6;353(14):1489-501