Cáncer de próstata y el músculo esquelético
Los hombres sobrevivientes del cáncer prostático suelen experimentar a nivel esquelético efectos adversos persistentes tales como osteoporosis y osteomalacia. Estos trastornos óseos a menudo están asociados con la edad, pero también pueden exacerbarse por la exposición al cáncer y su tratamiento.
Terapia del cáncer prostático
El cáncer de próstata es la neoplasia más frecuente en los hombres. Para el 2012, se estima que un total de 241.740 nuevos casos se diagnosticarán en los Estados Unidos, y 28.170 hombres morirán de la enfermedad. Dado que la señalización de los receptores de andrógenos desempeña un papel importante en la biología del cáncer, la terapia de deprivación androgénica (ADT, por sus siglas en inglés) se utiliza ampliamente en hombres con cáncer de próstata localmente avanzado y metastásico; de hecho, más de medio millón de ellos en los Estados Unidos están recibiendo la ADT. Aunque el tratamiento ha mejorado la supervivencia en un subgrupo de personas con la enfermedad localmente avanzada, sus beneficios se han visto, al menos en parte, atenuados por sus efectos adversos. Los pacientes que reciben ADT tienen menos masa y fuerza muscular, anemia, disfunción sexual, y la pérdida acelerada de huesos, además de fracturas. El procedimiento también hace que sean más susceptibles a la diabetes mellitus y eventos cardiovasculares.
Son poco conocidos los mecanismos que aumentan el riesgo cardiometabólico, pero la pérdida de masa en el músculo esquelético, la acumulación de grasa y la inflamación, son posiblemente los principales contribuyentes. La disrupción genética del receptor de andrógenos en ratones genera pérdida de masa muscular, acumulación de grasa y resistencia a la insulina, resaltando el importante papel de los andrógenos como reguladores de la masa muscular y del metabolismo. Del mismo modo, la inducción experimental de hipogonadismo en hombres sanos también se traduce en resistencia a la insulina.
Una creciente evidencia sugiere que el músculo esquelético regula el tejido adiposo y el metabolismo, aumentando la posibilidad que las intervenciones anabólicas promiogénicas incrementen la masa muscular esquelética, y que además de sus efectos beneficiosos previstos en la sarcopenia y fragilidad, mejore los resultados cardiovasculares y metabólicos en hombres con ADT. Por lo tanto, es necesario realizar investigaciones básicas de los mecanismos que vinculan las hormonas anabólicas, el músculo y el metabolismo, para avanzar en la comprensión de la conexión entre el músculo esquelético con el metabolismo, y descubrir nuevas dianas para la prevención y tratamiento de las complicaciones cardiometabólicas de la ADT.
La noción de que el músculo esquelético regula el metabolismo es atribuible en gran parte a las observaciones que las contracciones musculares liberan interleuquina-6, una mioquina que mejora la sensibilidad a la insulina. Desde entonces, los estudios en modelos preclínicos han demostrado que las intervenciones promiogénicas que aumentan la masa muscular esquelética y la contractilidad mejoran los resultados cardiometabólicos. Por ejemplo, la miostatina, un miembro de la superfamilia del factor de crecimiento transformante β (TGF-β), inhibe el crecimiento a través del receptor de la activina tipo IIB. Mutaciones de origen natural en el gen de la miostatina se asocian con la hipermuscularidad y menos masa grasa en muchas especies de mamíferos, incluyendo los seres humanos. Los ratones carentes de miostatina son delgados e hipermusculares y resistentes a la acumulación de grasa, con desarrollo de esteatosis hepática, resistencia a la insulina, dislipidemia proaterogénica, y progresión de aterosclerosis. Por el contrario, los transgénicos que sobre-expresan la miostatina tienen menor masa muscular y mayor masa grasa que los controles tipo salvaje. Del mismo modo, los transgénicos que constitutivamente sobre-expresan Akt1, una proteína quinasa que regula el crecimiento muscular, tienen hipertrofia muscular, reducción del tejido adiposo blanco, y mejoras en la sensibilidad a la insulina y la esteatosis hepática. La administración de folistatina, otra proteína extracelular que bloquea las acciones de algunos miembros de la familia TGF-β, incluida la miostatina, aumenta la masa muscular esquelética, reduce la masa grasa y optimiza el metabolismo.
En estado estacionario, la masa del músculo esquelético representa un equilibrio homeostático entre las vías de señalización que regulan el crecimiento muscular (por ejemplo, las vías del receptor del factor androgénico β-catenina y del factor de crecimiento similar a la insulina objetivo de mamíferos I-Akt de la rapamicina [mTOR]) y los que regulan la atrofia muscular (por ejemplo, TGF-β-SMAD, ubiquitina-proteasoma, y la autofagia) (fig. 1). Estas vías de señalización están interrelacionadas y fuertemente entrecruzadas entre sí. Varias moléculas promiogénicas que dirigen a estas vías, tales como el modulador selectivo de los receptores de andrógenos, los secretagogos de la hormona de crecimiento, el factor de crecimiento I mimético análogo a la insulina, antagonistas de la miostatina y las folistatinas, están siendo evaluadas en ensayos clínicos para analizar sus efectos sobre la fragilidad, la caquexia por cáncer, el metabolismo, y diversas formas de distrofias musculares. Debido a que promueven el crecimiento de los andrógenos, la hormona de crecimiento similar a la insulina y el factor de crecimiento I sobre la próstata, los antagonistas de miostatina y folistatina, pueden ser candidatos terapéuticos para los pacientes bajo ADT. Están en desarrollo clínico numerosas estrategias innovadoras para antagonizar la acción de la miostatina, que incluyen anticuerpos monoclonales anti-miostatina, un propéptido de miostatina que se une en un complejo inactivo, inhibidores de la escisión proteolítica del precursor de la miostatina en su forma activa, receptores que bloquean la unión de la miostatina a su receptor, e inhibidores receptor de activina tipo IIB (fig. 2). También están siendo investigados la folistatina recombinante y los inhibidores de histona deacetilasa que inducen la expresión de folistatina.
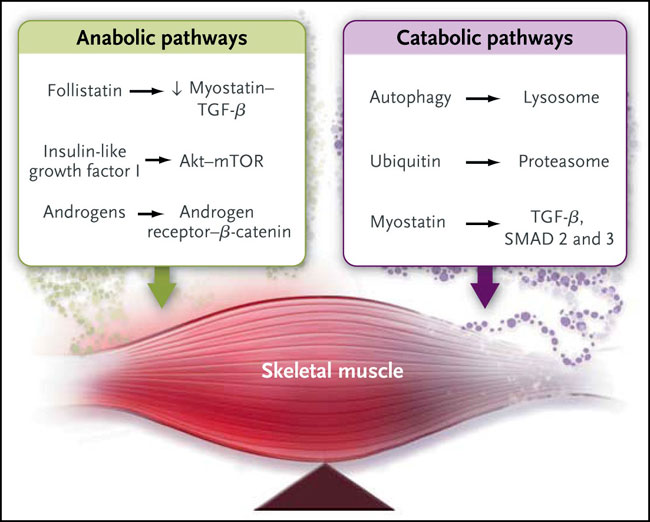
Los andrógenos, hormonas de crecimiento mimético, y las folistatinas activan las vías anabólicas, un proceso que acumula masa muscular. En el proceso contrario, las vías catabólicas reguladas por miostatinas y ubiquitinas, generan ligasas durante la descomposición del músculo esquelético. La abreviatura mTOR denota el objetivo en mamíferos de la rapamicina, y TGF-β factor β de crecimiento transformante.
Además de la interleucina-6, la miostatina y la folistatina, varios productos de secreción del músculo esquelético (por ejemplo, la interleucina-8, interleucina-15, como proteínas 1 y 3 similares a folistatina, e irisina) se han postulado como mioquinas. Éstas pueden mejorar el metabolismo por diversos mecanismos, incluyendo la regulación de la generación de grasa parda, lipólisis, oxidación ácido graso β, la secreción y acción de la insulina, la inflamación y angiogénesis. Como ilustración, la irisina, una mioquina dependiente del receptor activado por proliferadores de peroxisomas-α (PGC1-α), mejora el gasto de energía, la termogénesis y la homeostasis de la glucosa por el "pardeamiento de la grasa" (es decir, la conversión del tejido adiposo blanco rico en lípidos a tejido adiposo pardo metabólicamente activo y rico en mitocondrias). Por lo tanto, deberían ser estudiados los mecanismos por los que las mioquinas regulan el metabolismo y sus aplicaciones potenciales en la prevención y tratamiento de trastornos metabólicos asociados con la ADT.
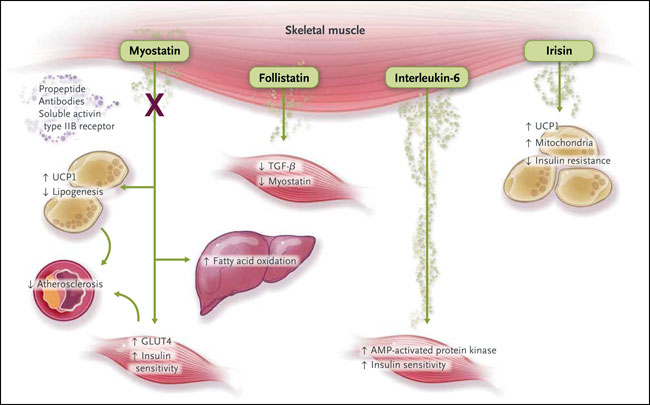
Las mioquinas producidas por el metabolismo del músculo esquelético están influenciadas por diversos mecanismos, tales como la regulación de la grasa parda, oxidación de los ácidos grasos y la mejora en la sensibilidad a la insulina. El bloqueo de la acción de la miostatina también optimiza el perfil metabólico y atenúa la aterogénesis. GLUT4 representa el transportador de glucosa tipo 4, y UCP1 a la proteína de desacoplamiento 1.
Las perturbaciones metabólicas que se han observado en pacientes tratados con ADT sugieren la existencia de un eje entre el músculo esquelético y el metabolismo, proporcionando una importante oportunidad para investigar los mecanismos por los que la pérdida de las señales anabólicas y la sarcopenia resultante contribuyen a la desregulación metabólica. Estos individuos ofrecen un modelo único de profunda deficiencia de andrógenos y pérdida muscular que no puede replicarse clínica o experimentalmente durante periodos prolongados de tiempo. Por otra parte, la alta incidencia de diabetes y eventos cardiovasculares en estos hombres hace que sea factible llevar a cabo una observación detallada, así como los estudios de intervención que analicen los mecanismos subyacentes. Estos y otros modelos preclínicos tienen el potencial de dilucidar nuevas dianas para el descubrimiento de fármacos promiogénicos y también mioquinas que reduzcan el riesgo de sarcopenia y fragilidad, lo que permitiría utilizarlos en la prevención y tratamiento de las complicaciones cardiometabólicas de la ADT.
Fuente bibliográfica
Targeting the Skeletal Muscle–Metabolism Axis in Prostate-Cancer Therapy
Shehzad Basaria, M.D., and Shalender Bhasin, M.D.
Department of Medicine, Division of Endocrinology and Metabolism, Boston University School of Medicine, Boston.
N Engl J Med 2012; 367:965-96