Cocina cardíaca: de fibroblastos a cardiomiocitos
El corazón humano está compuesto de cardiomiocitos, células vasculares y fibroblastos. De hecho, estas últimas unidades representan más del 50% de todas las células del corazón. Los fibroblastos cardíacos son diferenciados plenamente a células somáticas que proporcionan la estructura de soporte, las señales de secreción, y contribuyen a la cicatrización en el daño cardíaco. Los fibroblastos derivan de una fuente extra-cardíaca de células conocidas como proepicardio, y normalmente no tienen un potencial cardiogénico.
La enfermedad cardíaca es la principal causa de mortalidad en adultos y niños. La patología subyacente corresponde habitualmente a la pérdida de cardiomiocitos que conduce a la insuficiencia cardíaca o al desarrollo inadecuado de los cardiomiocitos durante la embriogénesis generando malformaciones cardíacas congénitas. Debido a que los cardiomiocitos postnatales tienen poca o ninguna capacidad de regeneración, los enfoques terapéuticos son extremadamente limitados. Por otra parte, las células madre embrionarias tienen un claro potencial cardiogénico, pero la eficiencia de la diferenciación cardíaca, el riesgo de formación de tumores y los problemas de rechazo celular aún deben ser superados. La capacidad de reprogramar los fibroblastos en células madre pluripotentes inducidas (CMPi) podría abordar algunos de estos problemas al proporcionar una fuente alternativa de células embrionarias. Sin embargo, la generación de suficientes cardiomiocitos derivados de CMPi puros y maduros, sigue siendo un sorprendente reto.
Reprogramación de fibroblastos en cardiomiocitos
La falta de cardiomiocitos es la explicación en la mayoría de los casos de insuficiencia cardíaca, y los científicos han buscado durante mucho tiempo la posibilidad volver a recomponer el corazón con nuevos cardiomiocitos. Los intentos de remuscularización se han basado en el trasplante de células madre o sus derivados, pero con moderado éxito hasta la fecha. Un reciente estudio realizado por Masaki Ieda y colegas (Cell 2010; 142:375-386) plantea una nueva estrategia terapéutica: la reprogramación de fibroblastos para convertirlos en cardiomiocitos.
El paradigma de la reprogramación celular se originó con el siguiente descubrimiento en 1987: la expresión del gen del músculo esquelético, MYOD1, podría inducir a múltiples tipos de células a diferenciarse en músculo esquelético. MYOD1 codifica un factor de transcripción que regula la traducción de ARN de los genes diana. Este hallazgo alimentó la hipótesis que la activación de factores transcripcionales maestros conduce a la diferenciación de tipos celulares específicos. Desafortunadamente, la mayoría de los elementos de transcripción parecen regular sólo un subgrupo de los genes necesarios para la diferenciación de diferentes formas celulares, y la investigación no ha podido identificar a otros reguladores maestros de equivalente potencial a MYOD1. El interés sobre la reprogramación se recuperó gracias a Kazutoshi Takahashi y Shinya Yamanaka que realizaron otro descubrimiento histórico en 2006 respecto a que fibroblastos maduros podrían ser reprogramados transcripcionalmente en células madre pluripotentes. Aunque no se identificó un factor de transcripción específico, se sabe de la existencia de una combinación de 25 factores normalmente presentes en las células madre embrionarias capaces de reprogramar los fibroblastos a la pluripotencia. Un cuidadoso cribado identificó cuatro factores de transcripción que se requieren para esta reprogramación. Sorprendentemente, todos los ratones utilizados pudieron ser generados a partir de células madre pluripotentes inducidas.
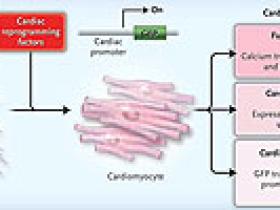
Alentados por estos resultados, M. Ieda y colaboradores, expresaron en fibroblastos de ratón 14 genes reguladores cardíacos, la mayoría codificadores de factores de transcripción. Con la idea de acelerar el proceso de selección, los fibroblastos fueron diseñados para expresar la proteína verde fluorescente (o GFP, por sus siglas en inglés, green fluorescent protein) durante la diferenciación cardíaca. La transducción con los 14 factores indujo la expresión de GFP en aproximadamente el 1% de las células. Los 14 factores fueron cuidadosamente cribados a 3 factores de transcripción - MEF2C, Gata4, y Tbx5 - que eran necesarios y suficientes para activar la expresión de GFP en el 20% de las células (figura 1). Los fibroblastos de la cola de los animales también pudieron ser reprogramados de esta manera, aunque de forma menos eficiente, descartando la contaminación por cardiomiocitos maduros o células progenitoras cardíacas. El mantenimiento de este estado inducido por los cardiomiocitos no requirió la expresión continua de factores de reprogramación. Cuando los fibroblastos fueron trasplantados en el corazón un día después de la transducción (pero antes de la activación de GFP), algunas de las células se sometieron a la diferenciación cardíaca in vivo.
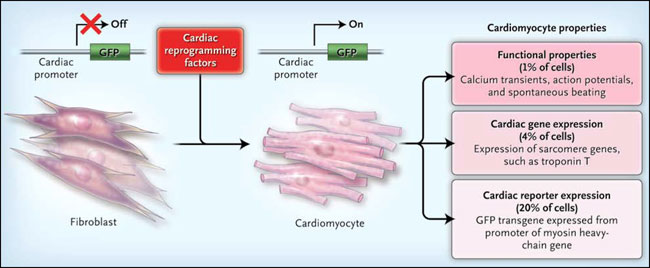
Masaki Ieda y colegas demostraron recientemente que la expresión de factores específicos de transcripción en fibroblastos de ratón puede motivar la trans-diferenciación de células en un cardiomiocito, como lo demuestra la expresión de la proteína verde fluorescente (GFP), diseñada de tal manera que se activa sólo en los cardiomiocitos. Las células reprogramadas alcanzan distintos niveles de identidad de cardiomiocitos, por ejemplo, un 20% tenía expresión a través de un transgen GFP, un 4% poseía expresión cardíaca de los genes del sarcómero (por ejemplo, la troponina T), y el 1% presentaba contracciones espontáneas y otras propiedades funcionales de los cardiomiocitos.
La activación de un gen reportero de restricción cardíaca, por cierto, no es lo mismo que la diferenciación cardíaca completa. Uno debe mirar por la pérdida del fenotipo de los fibroblastos, la expresión endógena de proteínas cardíacas, y más importante, la evidencia que las células funcionan como cardiomiocitos. Con el uso simultáneo de micro-ensayos para el perfil de miles de transcripciones de ARN, el grupo de M. Ieda encontró que células GFP positivas inhibían los marcadores de fibroblastos, como los colágenos, y expresaban muchos genes cardíacos. Una minoría de células GFP positivas expresaron otros genes del sarcómero cardíaco, y una pequeña fracción de complejos fenotipos cardíacos, tales como el incremento transitorio de calcio y la caída espontánea de actividad (figura 1). Por lo tanto, un subgrupo de células reprogramadas tenían las propiedades fisiológicas de los cardiomiocitos, pero la mayoría fueron reprogramadas sólo parcialmente.
La reprogramación de los fibroblastos a cardiomiocitos tiene un enorme potencial para el tratamiento de la insuficiencia cardíaca. En teoría, los fibroblastos de una muestra de biopsia de piel, por ejemplo, podrían utilizarse en generar cardiomiocitos autólogos para la reparación de la insuficiencia cardíaca. Aún más interesante sería una reprogramación in situ de los fibroblastos en el corazón herido. Este enfoque podría redirigir estas células formadoras de cicatriz hacia la re-muscularización, eludiendo así las dificultades con la supervivencia del injerto y su integración. En efecto, in situ, los fibroblastos de infarto se han reprogramado para el músculo esquelético con el uso de MYOD1, proporcionando una importante prueba de concepto para este enfoque.
Aún queda mucho por hacer antes que esta metodología esté lista para la traducción clínica. Los hallazgos deben ser reproducidos por investigadores independientes. Sólo una pequeña minoría (alrededor del 1%) de los miocitos reprogramados parece terminar en cardiomiocitos capaces de latir, por lo que la eficiencia de la generación de unidades funcionales requiere una mejora sustancial. Se necesita de sistemas de reprogramación sin la participación de virus, y hay que saber si el estado de los cardiomiocitos inducidos persiste en el largo plazo. Por último, debemos demostrar que estas células pueden integrarse en el corazón dañado, latir de forma sincrónica con el miocardio de acogida, y restaurar la función eléctrica y contráctil. Frente a los muchos obstáculos potenciales, la capacidad de reprogramar los fibroblastos a cardiomiocitos podría revolucionar el campo de la reparación cardíaca.
Fuente bibliográfica
Reprogramming Fibroblasts into Cardiomyocytes
Charles E. Murry, M.D., Ph.D., and William T. Pu, M.D.
From the Departments of Pathology, Bioengineering, and Medicine/Cardiology, Center for Cardiovascular Biology, Institute for Stem Cell and Regenerative Medicine, University of Washington, Seattle (C.E.M.); the Department of Cardiology, Children’s Hospital Boston, Boston (W.T.P.); and Harvard Stem Cell Institute, Cambridge, MA (W.T.P).
N Engl J Med 2011; 364:177-178