Sepsis
Sepsis: un viejo enemigo
La sepsis es la principal causa de muerte en pacientes críticamente enfermos. En los Estados Unidos, se desarrolla en unas 750.000 personas cada año, y más de 210.000 mueren. Después de numerosos ensayos infructuosos con agentes antiinflamatorios en pacientes con sepsis, muchos investigadores han dudado que la mortalidad pueda reducirse. Pero los avances respecto a la comprensión de las bases en la fisiopatología y genética han podido dilucidar, en parte, la respuesta del huésped contra la infección, cambiado la visión prevaleciente del síndrome, y a la fecha, varias terapias en modelos animales clínicamente relevantes han demostrado una eficacia sorprendente.
Inmunosupresión, VIH y sepsis
El shock séptico es visto tradicionalmente como una reacción sistémica inflamatoria descontrolada frente a patógenos microbianos invasivos, sin embargo, los esfuerzos para mejorar el pronóstico de los pacientes por medio de inhibidores de citoquinas proinflamatorias y mediadores no han tenido éxito. Ocasionalmente, los pacientes presentan una exagerada respuesta sistémica inflamatoria frente a patógenos altamente virulentos (como en los casos de la meningococemia) y sucumben rápidamente. Sin embargo, la gran mayoría de los pacientes con sepsis sobreviven a la lesión inicial, terminando sólo en la unidad de cuidados intensivos por su disfunción multiorgánica días o semanas después. La inmunosupresión inducida por sepsis es reconocida como la principal alteración inmune en este grupo altamente vulnerable.
La relevancia clínica de este estado inmunodeprimido se evidencia por la frecuente ocurrencia de la infección por la relativa avirulencia y, a menudo por la multirresistencia bacteriana, viral o por hongos patógenos, tales como especies de estenotrofomonas, acinetobacter, cándida, pseudomonas, enterococos y citomegalovirus. A la luz de la progresiva resistencia a los antibióticos y la escasez de nuevos agentes en vías de desarrollo, el cuidado de los individuos con sepsis es cada vez más desafiante. La afección se puede considerar como una carrera entre los patógenos y la respuesta inmunitaria del huésped; los patógenos buscan una ventaja incapacitante para diversos aspectos relacionados con las defensas del enfermo. Por ejemplo, inducen el agotamiento por apoptosis de las células efectoras inmunes, reprimen la expresión de las moléculas del complejo mayor de histocompatibilidad clase II, aumentan la expresión de moléculas co-estimuladoras negativas, incrementan las citoquinas antiinflamatorias y elevan los niveles de células T reguladoras y de las células supresoras de origen mieloide (figura 1). La prevención de la inmunosupresión inducida por sepsis, o su tratamiento, es una prioridad para la biomedicina actual.
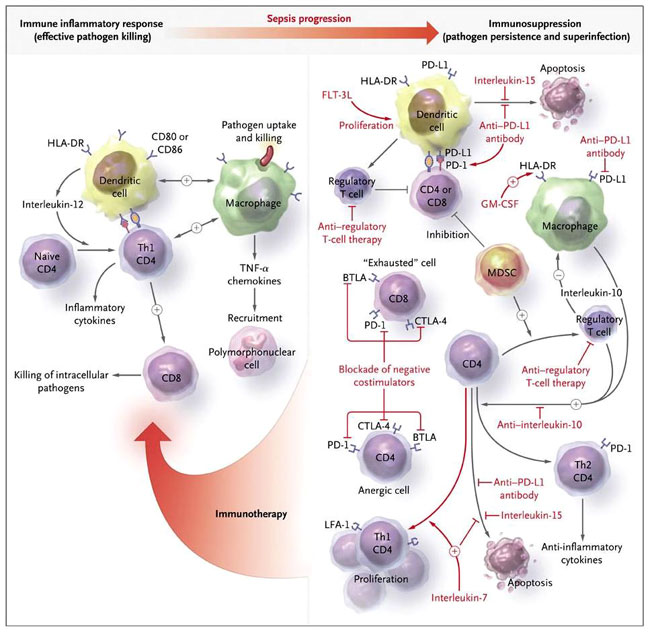
En muchos casos, el sistema inmunitario no logra erradicar los patógenos infecciosos, y comienza una fase prolongada de inmunosupresión inducida por sepsis, caracterizada por la falla en la erradicación de la infección primaria y secundaria mediante la aparición de infecciones nosocomiales. Esta inmunosupresión está mediada por múltiples mecanismos, incluyendo el masivo agotamiento de linfocitos y células dendríticas, disminución de la expresión del complejo HLA-DR, y aumento de expresión de las moléculas co-estimuladoras muerte programada 1 (PD-1), de los linfocitos T citotóxicos asociados a antígeno 4 (CTLA-4) y del atenuador de los linfocitos B y T (BTLA) y sus ligandos correspondientes (por ejemplo, ligando PD-1 [PD-L1]). Por otra parte, el número de células T reguladoras y células supresoras de origen mieloide (MDSCs) se incrementan, y hay un cambio de un fenotipo helper T tipo 1 inflamatorio (Th1) hacia células con fenotipo helper T tipo 2 inflamatorio (Th2) caracterizo por la producción de interleucina-10. El resultado neto es un sistema inmune innato y adaptativo muy comprometido, con funcionalidad CD8 "agotada" y células T CD4 anérgicas. Los objetivos de posibles manejos inmunoterápicos (en rojo) incluyen agentes bloqueadores de la apoptosis, el bloqueo negativo de moléculas co-estimuladoras, reducción del nivel de citoquinas antiinflamatorias, aumento de la expresión de HLA-DR, y reactivación de las células T "agotadas" o anérgicas. FLT-3L denota al ligando tirosina quinasa 3 similar a Fms, GM-CSF factor estimulante de colonias de granulocitos y macrófagos, LFA-1 Antígeno-1 de función asociada a linfocito y TNF-alfa (factor de necrosis tumoral alfa.
Un estudio reciente realizado por Elias A. Said y colegas (Nat Med 2010; 16:452-459) proporciona información detallada sobre los mecanismos moleculares que subyacen a la depresión inmunitaria tras la inflamación sostenida, como ocurre durante las infecciones virales crónicas o prolongadas de la sepsis. Estos investigadores estudiaron una proteína crítica para monocitos y macrófagos conocida como molécula de muerte programada 1 (PD-1), que se encuentra en los pacientes infectados con el virus de la inmunodeficiencia humana (VIH). La PD-1, una molécula co-estimuladora negativa expresada en las células efectoras inmunes, está sobre-regulada junto con su ligando afín PD-L1 (también expresado en células efectoras) durante la infección crónica por VIH. Said y colaboradores encontraron que los mediadores microbianos son translocados en el epitelio intestinal durante la inflamación crónica inducida por el VIH y son reconocidos por los receptores tipo toll. La activación persistente del sistema inmune innato por estos productos microbianos derivados intestinalmente sobre-regula la expresión de PD-1 y PD-L1 en varias células del sistema inmune.
PD-1 daña la inmunidad mediante la inducción de la apoptosis, aumentando la producción de interleucina-10 (una citocina antiinflamatoria clave que aumenta en la sepsis), previene la proliferación de células T y provoca que las células T no respondan ("agotadas"). El grupo de Said describió un nuevo mecanismo por el cual la interacción entre la EP-1 y PD-L1 induce la inmunosupresión en pacientes con VIH. Ellos encontraron que la activación de PD-1 resulta en el aumento de la producción de interleucina-10 por los monocitos de las personas infectadas con VIH. Por otra parte, la inhibición de las células T CD4 inducida por PD-1 fue en sí inhibida por el bloqueo del receptor de la interleucina-10. Por lo tanto, PD-1 afecta a la inmunosupresión a través de su efecto sobre la expresión de la interleucina-10. Estos resultados sugieren que el bloqueo de PD-1 puede mejorar el pronóstico de los pacientes con infecciones crónicas. Los hallazgos son consistentes con la mejora de la supervivencia en ratones con infecciones por hongos, y en ratones con sepsis bacteriana, en el que la molécula PD-1 es inhibida.
Aunque es posible que la terapia inmunoestimulante exacerbe la fase hiperinflamatoria de la sepsis o induzca autoinmunidad, los ensayos clínicos con interferón-gamma, un potente agente inmunoestimulante, y el factor estimulante de colonias de granulocitos y el factor estimulante de colonias de granulocitos y macrófagos (GM-CSF) en pacientes con diversos estados inflamatorios sistémicos, no suscita reacciones inflamatorias desenfrenadas. La mayoría de los pacientes con sepsis refractaria están tan severamente inmunodeprimidos que el desarrollo de hiperinflamación o autoinmunidad es poco probable.
Para evitar el excesivo agotamiento de las células efectoras inmunes inducido por la apoptosis en pacientes con sepsis, una posible estrategia podría ser el uso de las inmunoestimulantes citocinas interleucina-7 y la interleucina-15, ambas agentes antiapoptótics que han demostrado eficacia en modelos de infección, incluyendo la sepsis. Estas citocinas, al prevenir la muerte celular, disminuyen el efecto inmunosupresor de las células fagocíticas. La interleucina-7 también restablece la función efectora de los linfocitos y mejora la migración de linfocitos al incrementar la actividad de las integrinas. La interleucina-7 se evalúa actualmente en ensayos clínicos para tratar el cáncer y la infección con virus de la hepatitis C y el VIH.
En el futuro, la inmunoterapia, probablemente se adaptará a cada paciente en función de las características específicas clínicas o de laboratorio. Por ejemplo, un actual estudio de GM-CSF para tratar la sepsis prueba su efecto sólo en pacientes en que la expresión de HLA-DR presenta una considerable baja. Los estudios de citometría de flujo cuantifican el nivel de expresión de moléculas coestimuladoras negativas (como EP-1 y PD-L1) en leucocitos, o los ensayos de estimulación rápida de sangre total para la secreción de citocinas, podrían ser utilizados para guiar las decisiones en la inmunoterapia. Los pacientes con infección por citomegalovirus o reactivación del virus herpes simple tipo 1 y aquellos con sepsis debido a la infección por patógenos oportunistas (estenotrofomonas o acinetobacter) son buenos candidatos para la terapia inmunopotenciadora.
Un viejo refrán dice, "enfermedades desesperadas se curan por medios desesperados, o no en absoluto”. Los ensayos de agentes inmunoestimulantes deben llevarse a cabo, con un control estricto de la función inmune innata y adaptativa, en pacientes con inmunosupresión demostrada. Muchos agentes inmunomoduladores potencialmente beneficiosos (figura 1) se encuentran actualmente siendo evaluados en ensayos clínicos para otras indicaciones y tienen perfiles de seguridad razonables. Se podría especular que estos enfoques podrán tener efectos de gran alcance y representar un importante avance en el campo de las enfermedades infecciosas.
Fuente bibliográfica
Immunotherapy for Sepsis — A New Approach against an Ancient Foe
Richard S. Hotchkiss, M.D., and Steven Opal, M.D.
Department of Anesthesiology, Washington University School of Medicine, St. Louis, USA.
N Engl J Med. 2010 Jul 1; 363(1):87-9