¿Inmunidad innata contra el VIH?
El virus de la inmunodeficiencia humana (VIH) aprovecha la maquinaria de la célula huésped para maximizar la producción de partículas virales. En contraste, las células humanas poseen múltiples sistemas que las hacen resistentes a la infección viral a través de la acción de factores innatos de restricción. Este sistema intracelular natural a su vez puede ser modificado por ciertas proteínas virales, creando un conflicto entre las células del huésped y los agentes patógenos.
Recientemente, una proteína transmembrana, la teterina, ha sido identificada como un factor antiviral en células infectadas por el VIH-1, reteniendo los viriones recién formados en la membrana plasmática y evitando su liberación viral de las mismas células. Sin embargo, los mecanismos moleculares precisos que permiten esta inmovilización del virión son en gran medida desconocidos.
Inmunidad innata: inhibición celular de la liberación del VIH-1
La respuesta inmune innata a la infección viral incluye un estado antiviral inducido por interferones tipo I. ¿Cuáles son las proteínas efectoras de este estado antiviral, y cómo funcionan? Un reciente artículo de David Pérez-Caballero y colegas (Cell 2009; 139(3):499-511) indica que la proteína celular de estroma de médula ósea antígeno 2 (BST-2) inducida por interferón, conocida también como teterina, en el virus de inmunodeficiencia humana (VIH) evita que las partículas de la progenie (viriones) escapen de la superficie de la célula infectada a través de un mecanismo que requiere sólo las características estructurales más generales de la proteína.
El nombre teterina fue acuñado hace 2 años, cuando BST-2 (o antígeno CD317 y HM1.24) e identificada como un factor de acogida que inhibe la liberación de los viriones de células infectadas. Esta proteína, conocida por sus altos niveles de expresión en la superficie de las células malignas del mieloma múltiple, es un objetivo de la proteína Vpu del VIH tipo 1 (VIH-1). Se sabe que Vpu facilita la liberación de los viriones de las células colonizadas, al parecer para poder contrarrestar las proteínas celulares que inhiben la liberación. Aunque se expresa constitutivamente en ciertos tipos celulares, se ha demostrado que este inhibidor es inducido por otros interferones tipo I. La búsqueda de una proteína interferón-inducida que inhibiera la liberación del virión contrarrestado a Vpu llevó al descubrimiento de la teterina. Una vez que se identificó su actividad antiviral, el espectro de acción de la teterina se expandió rápidamente para incluir a una buena cantidad retrovirus, como por ejemplo, miembros de las familias de los filovirus (virus del Ébola y Marburg), arenavirus (virus de Lassa) y virus herpes (asociado sarcoma de Kaposi). Varios de estos virus codifican proteínas que actúan en contra de la teterina, aunque estos antagonistas son distintos, tanto estructural como mecánicamente, del Vpu.
Pero, ¿cómo la teterina es capaz de mantener los viriones en las células? Una potencial pista proviene de sus inusuales características topológicas: se une a la membrana lipídica dos veces, una a través de un dominio transmembrana y otra a través de un glucosilfosfatidilinositol (GPI) de anclaje de lípidos (figura 1). Con estas características, la teterina puede integrar uno de los extremos en la cubierta lipídica del virión y el otro en la membrana plasmática de la célula huésped, inmovilizando al VIH-1en la superficie celular. Como alternativa, desde el dominio extracelular de la proteína, probablemente se desprenda una estructura interactiva tipo "super-hélice", pudiendo interactuar con ella misma para mantener los viriones en las células. Cada uno de estos modelos sugiere que lateterina, de forma directa y autónoma, restringe la liberación, y cada uno permite que esté integrada en parte o en su totalidad dentro de la envoltura del virión. El grupo de D. Pérez-Caballero demuestra que este es el caso. La teterina puede insertarse en la membrana del virión a través de cualquiera de sus extremos. Estos están convenientemente situados a lo largo de la superficie celular para mantener a los viriones nacientes. Cada característica estructural de la proteína (es decir, su dominio transmembrana, la super-hélice y el anclaje GPI) es necesaria para la actividad antiviral. Sorprendentemente, estos rasgos estructurales es todo lo que se necesita para la función: una "teterina artificial" que los autores diseñaron a partir de tres diferentes proteínas celulares tiene actividad antiviral casi equivalente a la teterina nativa. Sin embargo, la Vpu del VIH-1 no es contrarrestada por la proteína artificial.
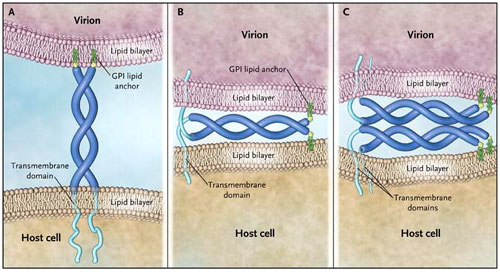
Diferentes formas en que la proteína antiviral teterina inducida por interferón podría mantener a los virus de la progenie (viriones) en las células, evitando la propagación. La teterina (azul) pasa a través de la bicapa lipídica, una vez establecida la unión, y por segunda vez se une a la bicapa a través de un enlace covalente glicolipídico (glucosilfosfatidilinositol [GPI, verde]) en su extremo. Además, la proteína es un dímero, y su dominio extracelular, probablemente forma una estructura "super-hélice", representada aquí como una cuerda trenzada de doble hebra. Los dímeros de teterina pueden abarcar la membrana del virión y la célula huésped (panel A), o los dominios de la "super-hélice" asociados al virión y de las moléculas asociadas a las células (paneles B y C), en cada caso previniendo el desprendimiento celular de los viriones recién formados. Un reciente estudio de Pérez-Caballero y colegas indica que al menos uno de estos modelos es correcto. La teterina se inserta en la envoltura del virión, y sus principales características estructurales (un dominio transmembrana, un dominio dimérico extracelular tipo "super-hélice" y un anclaje mediante glucolípidos) es todo lo que necesita para restringir la liberación de algunos virus con envoltura, como el de la inmunodeficiencia humana, de las células infectadas.
¿Qué oportunidades tiene la teterina artificial (y otros antagonistas virales) para ofrecer terapia antiviral? En principio, podría ser expresada en células como una molécula terapéutica, ya que probablemente el virus no sería capaz de contrarrestarla. En general, la identificación de la teterina como una proteína antiviral efectora de la respuesta inmune innata puede revitalizar el interés sobre Vpu y otras proteínas virales que antagonizan a la teterina como objetivos farmacológicos. Las proteínas virales "accesorias" como Vpu no han generado gran entusiasmo como objetivos farmacológicos, en parte porque - a diferencia de las enzimas virales como la transcriptasa inversa del VIH-1, proteasas o la integrasa - no son necesarias para la replicación viral in vitro. Sin embargo, los sistemas de cultivo in vitro pueden no reflejar la importancia de tales proteínas en vivo. ¿Es la teterina un mecanismo importante de defensa, digno de esfuerzos para sensibilizar farmacológicamente a los virus? El hecho que los virus posean información genética para codificar antagonistas de la teterina sugiere que la respuesta es sí. La inhibición de dichas unidades virales podría en principio permitir una respuesta inmune innata que atrape al VIH y a otros tipos de virus.
Fuente bibliográfica
How Innate Immunity Can Inhibit the Release of HIV-1 from Infected Cells
John Guatelli, M.D.
University of California, San Diego and the Veterans Affairs San Diego Healthcare System.
N Engl J Med. 2010 Feb 11; 362(6):553-4