Viaje al interior de la diabetes
La diabetes tipo 2, antes conocida como adulta o diabetes no insulinodependiente, es una condición crónica que afecta la manera como el organismo metaboliza el azúcar (glucosa), la principal fuente de energía. Su diagnóstico es cada vez más común en niños y adolescentes, especialmente en quienes son obesos. Algunos estudios muestran que entre el 8 y 45% de los niños que han sido recientemente diagnosticados diabéticos tipo 2, dependiendo de la situación geográfica y el grupo racial/étnico.
Cuando se padece diabetes tipo 2, el cuerpo es resistente a los efectos de la hormona que regula el movimiento de azúcar a las células, o no se produce suficiente insulina para mantener niveles normales de glucosa. Sin tratamiento, sus consecuencias pueden ser mortales, y si bien no hay cura, se puede manejar, o incluso evitar.
A través de los años, se ha visto que existen diversas alteraciones genéticas asociadas con la condición, pero los mecanismos exactos de la enfermedad todavía no han sido dilucidados completamente. Los nuevos avances médicos en esta área permitirán prolongar la calidad de vida y los años de las personas con diabetes tipo 2.
Receptores adrenérgicos α2A y diabetes tipo 2
La epidemia mundial de la diabetes mellitus tipo 2, ha sido impulsada, sin duda, por los crecientes niveles de obesidad. A pesar que el aumento de grasa deteriora la acción de la insulina, el riesgo de diabetes tipo 2 parece estar dominado por factores que afectan la secreción insulínica, ya que la mayoría de los genes identificados en estudios de asociación perjudican la fisiología de las células beta pancreáticas. En consonancia con esta tendencia, un reciente estudio de Anders H. Rosengren y colegas (Science 2009 November 19), identificó la asociación entre un polimorfismo del gen del receptor adrenérgico α2A (ADRA2A) y una disminución de la capacidad de las células beta pancreáticas para la liberar insulina. Las células beta de personas portadoras del alelo poseen muchos receptores, lo que altera el acoplamiento de los gránulos de insulina en la membrana plasmática, alineando las vesículas con insulina a la membrana, listas para liberar su contenido en respuesta a una mayor concentración de glucosa.
El proyecto comenzó con un estudio de diabetes en ratas Goto Kakizaki (GK), un modelo con liberación de insulina atenuada similar a la susceptibilidad diabética en seres humanos, con presencia de un locus en una región del cromosoma 10. Utilizando registros eléctricos para controlar la cantidad de insulina fusionada con la membrana plasmática en islotes únicos de células beta como fenotipo molecular, los autores cortaron un segmento de la región cromosómica implicada que contiene sólo cinco genes. Las ratas portadoras de los marcadores de susceptibilidad con estos cinco genes tenían una menor tasa de fusión de los gránulos de insulina y un número proporcionalmente más bajo de vesículas en línea a la membrana de las células beta.
Adra2a codifica el receptor adrenérgico α2A y es uno de los cinco genes en el locus de susceptibilidad reducida. Se sabe que la activación de los receptores adrenérgicos α2A suprime la secreción de insulina in vivo, lo que probablemente explica la intolerancia a la glucosa frecuentemente observada en pacientes con feocromocitoma, un tumor de la glándula suprarrenal.
Los islotes pancreáticos de ratas GK y sus descendientes susceptibles (que por definición comparten determinantes factores de riesgo genético) poseen más receptores adrenérgicos α2A que sus contrapartes no susceptibles, de acuerdo con demostraciones previas respecto a que las variaciones de secuencia fuera de la región codificante Adra2a pueden afectar los niveles de los receptores. Cuando los receptores adrenérgicos α2A fueron bloqueados por la yohimbina (un α-antagonista de receptores adrenérgicos), los islotes de los ratones mutantes se comportaron como islotes normales. Los resultados por lo tanto sugirieren que una excesiva cantidad de estos receptores adrenérgicos inhiben la liberación de insulina (figura 1).
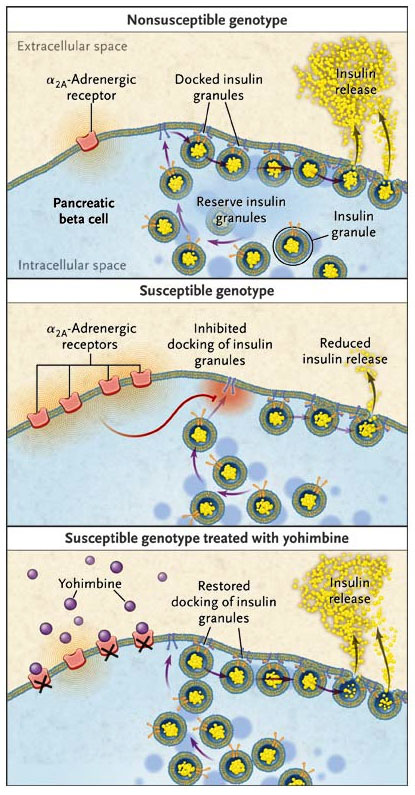
Investigadores demostraron que una pequeña zona genética estaba ligada con aumento de receptores adrenérgicos α2A. La señalización de estos receptores reducen la cantidad de vesículas de insulina ancladas en la membrana y por tanto la capacidad de las células para la liberación de la hormona. La inhibición farmacológica de los receptores adrenérgicos α2A por la yohimbina revirtió la liberación defectuosa de insulina en los islotes susceptibles a la diabetes.
Dado que el locus de susceptibilidad en ratas GK tiene un equivalente en el genoma humano, los autores evaluaron si las variantes del gen ADRA2A estarían asociadas con la anormal liberación de insulina. En dos grupos separados de sujetos sin diabetes, encontraron que los polimorfismos en y alrededor de ADRA2A se relacionaban con una menor secreción de insulina, y en un análisis caso-control se observó el vínculo con el riesgo de diabetes tipo 2. Tal vez sea difícil distinguir con precisión que el efecto descrito se deba al gen ADRA2A ya que se encuentra cerca de la secuencia que codifica el factor de transcripción 7-2 (TCF7L2), otro gen que influye en el riesgo de diabetes. Sin embargo, la asociación con ADRA2A aparentemente se mantuvo, incluso después del ajuste para el genotipo TCF7L2.
Muchos investigadores en diabetes deciden estudiar en los roedores en lugar de seres humanos debido a la limitada disponibilidad de islotes humanos para estudios funcionales. Rosengren y colaboradores, sin embargo, analizaron la secreción de insulina mediante islotes de donantes humanos y encontraron una correlación entre la función de las células beta pancreáticas y el genotipo ADRA2A. Al igual que en ratas, los islotes de los seres humanos portadores del riesgo asociado al polimorfismo ADRA2A tenían una mayor proporción de receptores adrenérgicos α2A, reduciendo la liberación de insulina estimulada por la glucosa, y un menor número de gránulos de insulina acoplados en preparación para la secreción, aunque no tras el bloqueo farmacológico de los receptores adrenérgicos α2A.
La receptor adrenérgico α2A se expresa en una variedad de tejidos y se sabe que tiene un papel en el control de la presión arterial y en la biología del tejido adiposo. La clonidina, por ejemplo, es un agonista de estos receptores y se cree que ejerce su efecto antihipertensivo actuando dentro del sistema nervioso central. En línea con esta idea, los portadores del alelo de riesgo ADRA2A con problemas de liberación de insulina tienen una menor presión arterial diastólica. Aunque los polimorfismos ADRA2A han demostrado tener una asociación con la presión arterial en la población humana, el tamaño del efecto muestra una variación considerable de acuerdo a la ascendencia, probablemente debido a la gran variedad de polimorfismos que interactúan sobre los niveles de expresión del receptor adrenérgico α2A.
Una sorprendente observación realizada por el grupo de A. H. Rosengren fue la magnitud del efecto de este polimorfismo en la función de las células beta. Nos hemos acostumbrado a ver la sutileza de los efectos de mutaciones, los cuales que son tan sutiles que apenas se pueden distinguir in vitro. Tal vez los investigadores tuvieron suerte en este caso, pero sus resultados nos señalan que cuando el método para medir la función de los islotes coincide precisamente con la vía defectuosa - tales como el uso de los registros eléctricos para controlar la fusión alterada de los gránulos de insulina - el efecto genético es notable. Esto concuerda con la visión que la diabetes se desarrolla normalmente sólo cuando la masa de células beta o la función se reducen considerablemente. Los hallazgos también pueden ayudar a explicar por qué algunos pacientes son más susceptibles que otros a la hiperglucemia de estrés, una situación asociada con altos niveles de adrenalina en circulación. La identificación de variaciones genéticas que son asignadas a una vía de señalización alterada en las células beta podría permitir el futuro desarrollo de tratamientos adaptados al genotipo de un paciente.
Fuente bibliográfica
α2A-Adrenergic Receptors and Type 2 Diabetes
Fiona M. Gribble, D.Phil., B.M., B.Ch.
Cambridge Institute for Medical Research, Addenbrooke's Hospital, Cambridge, United Kingdom.
N Engl J Med. 2010 Jan 28; 362(4):361-2