Ferroportina
La anemia de la inflamación
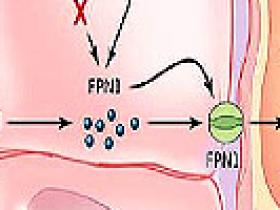
La ferroportina (FPN1), que participa en la exportación del hierro desde el interior de las células y la única proteína de trasporte del mineral que se ha caracterizado en mamíferos, tiene elementos de respuesta al hierro en su región no traducida 5’, que aseguran que su traducción sea reprimida por proteínas reguladoras en condiciones de deficiencia y así mantener el contenido celular. Sin embargo, se sabe que las células precursoras del epitelio duodenal y de los eritroides utilizan un promotor alternativo para expresar el transcriptor FPN1, FPN1B, el que carece del elemento de respuesta y no es reprimido en condiciones de deficiencia.
FPN1B codifica ferroportina con un idéntico marco de lectura que contribuye significativamente a la expresión de la proteína exportadora en los precursores eritroides y probablemente también en el duodeno en animales con falta de hierro. La identificación de FPN1B revela cómo la expresión FPN1 puede pasar por alto la represión dependiente de las proteínas reguladoras del hierro durante la recaptación intestinal, incluso cuando las células del cuerpo carecen de hierro.
Se ha señalado, que en las células precursoras eritroides la expresión de FPN1B aumenta la sensibilidad y mejora el estado, regulando la eritropoyesis en respuesta a la caída del hierro sistémico.
Eritrocitos y anemia
Al evaluar un paciente con anemia e inflamación, el médico observa el volumen corpuscular medio y luego pide los análisis bioquímicos para determinar los niveles de hierro y ferritina, y la saturación de la transferrina (calculada como la concentración sérica de hierro dividida por la capacidad total de unión del hierro, expresado como un porcentaje). Si la saturación de transferrina es inferior al 10% y el nivel de ferritina es menor a 30 ng por mililitro, la deficiencia de hierro es diagnosticada como causa de la anemia. Si la saturación de la transferrina es baja (15%) y el nivel de ferritina alta (> 200 ng/mL), generalmente se diagnostica un bloqueo inflamatorio.
Es un enigma clínico que el volumen corpuscular medio suela ser normal (en el 70% de los casos) y la anemia relativamente leve en pacientes con inflamación, ya que el suministro de hierro a la médula ósea está limitado, como lo indica la baja saturación de transferrina. De hecho, la entrega de hierro a la médula ósea debe ser aún menor en presencia de la inflamación que cuando hay deficiencia de hierro, ya que la capacidad total de unión del hierro (una medida indirecta del nivel de transferrina) es baja en los estados inflamatorios. Un reciente estudio realizado por De-LiangZhang y colaboradores (Cell Metab 2009; 9:461-473) parece resolver este misterio, así como hacer frente a un enigma sobre la hepcidina y la absorción de hierro en el tracto gastrointestinal.
La hepcidina es el principal regulador de la homeostasis del hierro. Los organismos no disponen de medios probados para modular su excreción, el contenido es controlado a través de la modulación de la adquisición y del almacenamiento del hierro. En pacientes con deficiencia férrica, la absorción es mayor, así como la liberación de los macrófagos. La absorción de hierro disminuye cuando el nivel es alto, y la liberación es inhibida. La hepcidina regula estos procesos de adaptación mediante el control de la expresión de la proteína ferroportina 1 (FPN1 [también conocida como SLC40A1]) en los enterocitos duodenales y el hierro reciclado de los macrófagos. La hepcidina se une a la ferroportina, llevando a la fosforilación y a la máxima degradación de la ferroportina. La síntesis de hepcidina disminuye por la deficiencia de hierro, en las anemias y en la hipoxia tisular, y aumenta por el exceso de hierro y la inflamación. En pacientes con inflamación, la abundancia de hepcidina conduce a una deficiente absorción de hierro en el tracto gastrointestinal, a la captación de hierro en los macrófagos, a un pobre reciclaje de hierro y a la anemia microcítica. Esta fisiopatología se denomina bloqueo inflamatorio.
Al investigar la regulación de la absorción de hierro en el tracto gastrointestinal, el grupo de Zhang descubrió una transcripción alternativa de ARN que codificaba para un tipo de ferroportina: FPN1B. En contraste con el transcrito previamente descrito (FPN1A), FPN1B carece de un elemento de respuesta al hierro en su región no traducida 5’, y por lo tanto su traducción continúa cuando el contenido celular de hierro es baja. Esto asegura que la absorción en la dieta (es decir, su emanación desde el enterocito a la circulación) se mantenga cuando una persona es deficiente (figura 1A). Aparentemente, los enterocitos duodenales actúan de forma altruista y pueden dar prioridad a la necesidad sistémica sobre el propio requerimiento celular de hierro.
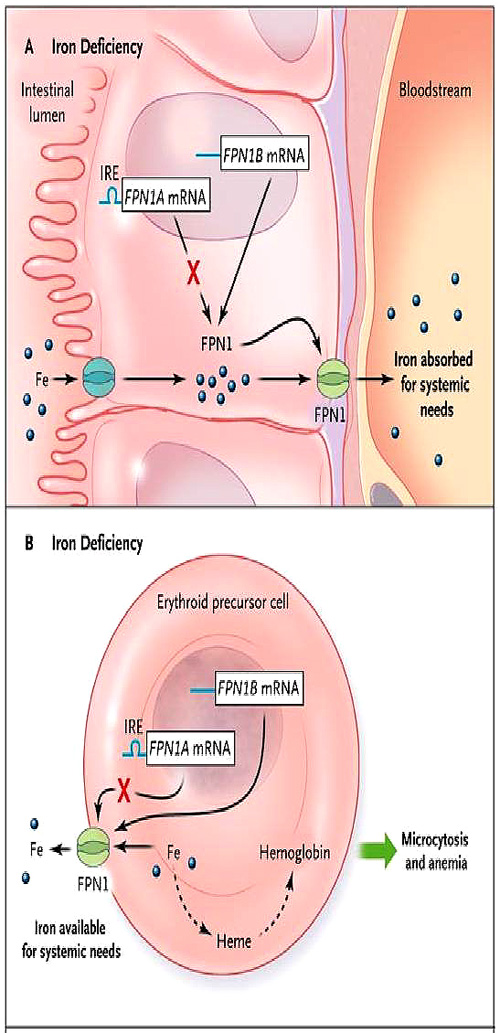
El panel A muestra el enterocito duodenal en estado de carencia férrica, en donde se reprime la traducción del ARN mensajero (ARNm) de la ferroportina FPN1A (línea azul). Debido a que el nivel de hepcidina es bajo, el hierro es exportado de manera eficiente, a través de FPN1, a la circulación sistémica. Los precursores eritroides funcionan de forma similar a los enterocitos en el contexto de la deficiencia de hierro (panel B). FPN1 permanece en la superficie celular, y el hierro se exporta fuera de los precursores eritroides según las necesidades sistémicas. Esto disminuye el nivel de hemo, y, a su vez, la síntesis de hemoglobina, que se refleja en la clínica como microcitosis y anemia. En el contexto de la inflamación (panel C), la interleucina-6 y otras citoquinas estimulan (por medio de un mecanismo independiente) los hepatocitos a secretar altos niveles de hepcidina. La hepcidina provoca la degradación de FPN1, bloqueando la salida de hierro a partir de precursores eritroides (línea discontinua), resultando en una preservación relativa de la síntesis de hemoglobina, volumen corpuscular medio (VCM), y la producción de glóbulos rojos.
Una sorpresa de estas investigaciones es que los precursores eritroides también expresan FPN1B. El análisis de las muestras de tejido reveló que FPN1B sólo se encuentra en células duodenales y precursores eritroides. No está claro por qué los precursores eritroides podrían exportar hierro cuando la hemoglobina representa más del 90% del contenido de proteína de los glóbulos rojos maduros. La hipótesis Zhang y colegas señala que la expresión de hepcidina permite la comunicación de la deficiencia de hierro sistémica (a través de ferroportina) a la médula eritroide, así como el duodeno, por lo que el eritrón puede desviar un poco de hierro a las necesidades sistémicas (a la mioglobina, citocromos, agrupaciones de hierro-azufre mitocondriales y a la síntesis de enzimas). Esto aumentaría la probabilidad que se cumplan los requerimientos de hierro de las células no eritroides. Sería importante para los autores y otros investigadores cuantificar la expresión y localización de ferroportina en los precursores eritroides y demostrar que la cantidad de hierro exportado es lo suficientemente alta para ser de relevancia fisiológica.
Aunque Zhang y colaboradores no discutieron esta posibilidad, sus observaciones también podrían explicar los resultados discrepantes en pacientes con deficiencia de hierro (figura 1B) y en aquellos con bloqueo inflamatorio (figura 1C). En el contexto de la inflamación, el nivel de hepcidina es alto, y la ferroportina, incluida la presente en los precursores eritroides, se degrada. En consecuencia, el hierro se mantiene dentro de los precursores eritroides, manteniendo el volumen corpuscular medio y protegiendo contra la anemia (figura 1C). Este mecanismo da prioridad a la producción de glóbulos rojos para el suministro de oxígeno, necesario para combatir los procesos inflamatorios tales como la infección crónica (por ejemplo, tuberculosis). Alternativamente, cuando falta hierro, el nivel de hepcidina es bajo, la ferroportina está presente en los precursores eritroides, y algo de hierro se exporta, lo que lleva a un bajo volumen corpuscular medio y anemia más severa (figura 1B).
Las situaciones clínicas son a menudo más complejas de lo que sugiere la figura 1: la eritropoyesis con deficiencia de hierro y los altos niveles de hepcidina pueden coexistir en un paciente. Ejemplos de esta complejidad, son los severos procesos inflamatorios como la artritis reumatoide juvenil y trastornos genéticos tales como la anemia ferropénica refractario. En los pacientes con estas complejidades, el nivel persistentemente elevado de hepcidina altera la absorción de hierro en la dieta, conduciendo finalmente a su carencia. Las personas con lupus eritematoso sistémico y hemorragia gastrointestinal asociada a aspirina (que resulta en la pérdida de hierro) tienen una fisiología similar.
El trabajo del grupo de Zhang confirma la naturaleza intrincada de la función de la hepcidina en la homeostasis del hierro y demuestra que la interacción es más complicada de lo que se creía anteriormente. Además, esto podría explicar las observaciones que hasta el día de hoy han sido confusas.
Fuente bibliográfica
The Microcytic Red Cell and the Anemia of Inflammation
Siobán B. Keel, M.D., and Janis L. Abkowitz, M.D.
From the Division of Hematology, University of Washington, Seattle.
N Engl J Med. 2009 Nov 5; 361(19):1904-6