La debilidad del cáncer
Alteraciones específicas en los miembros de la familia del gen RAS, H-RAS, K-RAS y N-RAS, puede convertirlos en oncogenes activos. Estos cambios son mutaciones puntuales que ocurren en los codones 12, 13 y 61. Se han encontrado oncogenes RAS activados en una proporción significativa de tumores, pero la incidencia varía considerablemente según el tipo: es relativamente frecuente (20-40%) en el cáncer de colon y la leucemia mieloide aguda, y ausente o poco presente en tumores de mama y cáncer de estómago. No se ha encontrado correlación, aún, entre la ausencia de un gen RAS activado y las características clínicas y biológicas de la malignidad.
La activación de oncogenes RAS es sólo un paso en el proceso de las múltiples etapas en la formación tumoral. La presencia de genes mutados RAS en pólipos benignos del colon indica que la activación puede ser un evento temprano, sin embargo, también puede presentarse más tarde en el curso de la carcinogénesis, por ejemplo, para iniciar la transición de un pólipo benigno en un carcinoma maligno o convertir un melanoma primario en un tumor metastásico. Al parecer, la activación de los genes RAS no es un evento obligatorio, pero cuando ocurre, puede contribuir tanto a los estadios tempranos y avanzados de la carcinogénesis humana.
Gen RAS y la carcinogénesis humana
Al terminar la secuenciación del genoma humano hace 6 años atrás, eran enormes las expectativas respecto a que este conocimiento pronto tendría un impacto en la capacidad médica para tratar enfermedades, especialmente las de carácter oncológico. Pero el avance sólo representó un conjunto de piezas, con mínimos indicios de funcionamiento en la práctica. Afortunadamente, casi al mismo tiempo, una poderosa herramienta tecnológica que interfería los ARN evaluaba de forma rápida las funciones biológicas de los genes. Los resultados combinados de estas dos áreas que forman la denominada "genómica funcional", podrían finalmente dar lugar a avances importantes en la terapia contra el cáncer. Claudia Scholl y colaboradores recientemente describen estos resultados (Cell 2009; 137(5):821-834).
Los tres oncogenes RAS estrechamente relacionados, K-RAS, N-RAS y H-RAS, se activan por mutaciones puntuales en el 20% de los tumores humanos y son particularmente frecuentes en páncreas, pulmón y colon. Se conoce bastante acerca de los mecanismos moleculares por los cuales las proteínas de unión al guanosín-trifosfato (GTP) promueven la malignidad celular, y es evidente que regulan las vías de señalización implicadas en el control de la proliferación celular, la supervivencia y la invasividad. Las moléculas controladas por RAS, tales como RAF, MEK y fosfatidilinositol 3-quinasa, están siendo blanco actualmente de medicamentos en ensayos clínicos. Sin embargo, ha sido imposible demostrar que RAS pueda ser controlado directamente con inhibidores de la farnesil transferasa, además de ser estos procedimientos muy costosos.
Ya que RAS ha demostrado ser resistente al ataque farmacológico, existe un considerable interés en la búsqueda de otros objetivos que podrían actuar como sustitutos. El grupo de C. Scholl ha utilizado la biblioteca de vectores de interferencia de ARN dirigidos a unos mil genes humanos, incluidos todos los que codifican quinasas, para determinar cuál de ellos era especialmente necesario para la supervivencia de las células tumorales que expresan oncogenes K-RAS activos (y por tanto no es requerido por las células normales o las células cancerígenas con lesiones oncogénicas diferentes) (figura 1). Mediante un panel de ocho líneas celulares para el cáncer, los autores observaron que la inhibición de la expresión de la serina/treonina quinasa 33 (STK33) resultó ser la más selectiva de estos miles de genes para eliminar a células mutantes K-RAS. El silenciamiento del ARN de STK33 también fue más eficaz que otros ARN en la inhibición de una gran gama de líneas celulares tumorales dependientes de K-RAS. Los autores sugieren que el control de STK33 puede ser un blanco atractivo para el tratamiento de cánceres con K-RAS mutantes.
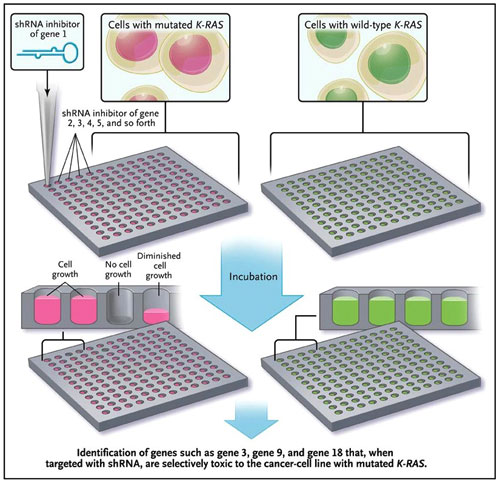
C. Scholl y colegas describen un panel de shRNAs (ARN de pequeñas horquillas) para el silenciamiento de diferentes genes capaces de controlar la leucemia mieloide aguda y eliminar otras líneas celulares tumorales con una mutación activadora en K-RAS. El panel muestra una lista de "hits" que silencian ARN que tienen como objetivo a la serina/treonina kinasa 33, los cuales eran más potentes en su capacidad para eliminar selectivamente células mutantes K-RAS.
Poco se sabe sobre STK33, incluida su función. Su secuencia parece estar más estrechamente relacionada con la subfamilia de la proteína quinasa dependiente de calcio/calmodulina, aunque carece del dominio necesario para la unión a calmodulina. C. Scholl y colegas demostraron que STK33 es requerido en las células K-RAS mutantes para mantener la actividad de la quinasa S6, un sustrato de mTOR, el objetivo de la rapamicina (ahora conocida como sirolimus), y es clave en la regulación de la síntesis de proteínas, sin embargo, se desconocen aún los detalles de cómo STK33 controla a mTOR. El análisis de la secuencia genética de STK33 en tumores no revela ningún signo evidente de mutaciones, y su nivel de expresión no es muy elevado. Por lo tanto, STK33 no es un oncogén propiamente tal, y probablemente sea una proteína celular normal. Este fenómeno ha sido recientemente llamado "adicción no oncogénica" para distinguirla de la "adicción oncogénica" descrita hace algún tiempo (por ejemplo, la necesidad continua de estas células para la expresión del oncogén K-RAS activado). Es posible que el estrés asociado con la transformación maligna impulsado por K-RAS permita que las células dependan en gran medida de determinadas vías de adaptación al estrés, de las cuales STK33 puede ser un componente importante. No habrá interés en el desarrollo de inhibidores de la quinasa hasta que no se pueda llegar a obtener una selectividad sobre las células tumorales, lo cual ha resultado muy difícil de conseguir hasta la fecha.
Otra forma de eliminación selectiva de K-RAS en líneas celulares de cáncer fue reportado recientemente por J. Luo y colegas, en este caso utilizando una biblioteca de ARN de interferencia que abarcaba el genoma humano de manera más completa. Esta técnica, llevada a cabo en células cancerígenes de colon y analizadas sobre un panel de líneas celulares de cáncer pulmonar, revelaron dependencias más complejas, con células mutantes K-RAS especialmente dependientes de los genes relacionados con la función de mitosis, como la quinasa tipo Polo 1 (Plk1), componentes del complejo que promueve la anafase y el proteasoma. Una vez más, es probable que estos “hits” no reflejan la "adicción sin oncogén".
En cierta medida, estos resultados nos llevan a la tan conocida susceptibilidad selectiva de las células RAS a los agentes que dañan el ADN y los medicamentos que activan los puestos de control mitótico, pero también pueden proporcionar un marco más racional para optimizar la explotación de estas sensibilidades y tal vez probar combinaciones de drogas sin explorar aún. Por ejemplo, este trabajo sugiere el estudio de la combinación de bortezomib, un inhibidor del proteasoma, con inhibidores de Plk1, lo cual se evalúa actualmente en ensayos clínicos. Tal estudio podría llevarse a cabo mucho antes del desarrollo de inhibidores de STK33. Si las investigaciones realizadas por el equipo de C. Scholl o por Luo y colegas condujeran a avances en el tratamiento de los cánceres con mutantes RAS, se justificaría ampliamente el enfoque empírico de la genómica funcional.
Fuente bibliográfica
Finding the Weakness in Cancer
Julian Downward, Ph.D.
Department of Medical Biochemistry, Sylvius Laboratories, University of Leiden, The Netherlands.
N Engl J Med. 2009 Aug 27; 361(9):922-4