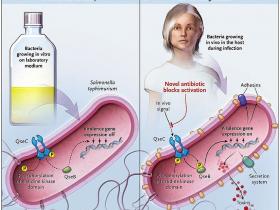
El caballo de Troya y su talón de Aquiles
Un desafío clave para la medicina es el desarrollo de nuevos medicamentos contra patógenos resistentes a los actuales agentes antimicrobianos. Una estrategia prometedora es identificar aquellos productos que inhiban la virulencia microbiana sin impedir el crecimiento, ya que esto presentaría menos presión selectiva para la generación de resistencia. Muchas bacterias reconocen el medio ambiente mediante la simple detección del hospedador y responden a las moléculas de señalización adrenérgicas adrenalina y nor adrenalina con el fin de promover la expresión de factores de virulencia. Estos patógenos parecen utilizar un mismo sensor de membrana, la histidina quinasa QseC, para reconocer las señales adrenérgicas del organismo y las señales bacterianas aromáticas autoinducidas-3 (AI-3) y así activar los genes de virulencia. Al detectar cualquiera de estas moléculas de señalización, QseC se auto-fosforila y posteriormente fosforila el factor de transcripción QseB, que inicia una compleja cascada de regulación y conduce a la transcripción de los genes claves para la colonización e invasión.
Homólogos de QseC están presentes en al menos 25 importantes patógenos humanos y vegetales, y se han descrito en animales infectados mutantes atenuados de qseC en Escherichia coli enterohemorrágica, Salmonella typhimurium y Francisella tularensisare. Debido a la función central de los receptores AI-3/epinefrina/NE QseC en la promoción de la virulencia de varios patógenos, es importante evaluar la eficacia de los inhibidores para estos receptores en un amplio espectro de antimicrobianos.
Virulencia bacteriana y sistemas biológicos
Una época dorada siguió al descubrimiento de la penicilina por Fleming, durante la cual se desarrollaron muchas clases de nuevos fármacos antibacterianos. La mayoría de estos antibióticos, como la estreptomicina y la tetraciclina, son derivados de compuestos naturales de microbios (a menudo, hongos o bacterias del suelo) liberados para eliminar a sus competidores que se encuentran cerca en el medio ambiente. Inicialmente, los antibióticos se identificaban mediante simple inhibición o muerte de las bacterias sensibles, las cuales se generaban en medios de cultivo (esto se conocen como cultivo in vitro).
Después de varias décadas de éxito, el rendimiento de los antibióticos naturales comenzó a disminuir, y las compañías farmacéuticas generaron nuevos y más sofisticados métodos para mejorar la productividad. Estos enfoques requieren el uso de complejas librerías que contengan miles de compuestos de alto rendimiento, a veces con procesos automatizados. El cribado frecuentemente se realizaba contra las bacterias cultivadas in vitro, pero en los últimos años se están utilizando proteínas purificadas. Sin embargo, incluso con estos sofisticados enfoques, ha sido difícil generar nuevas clases de antibióticos.
Una limitación de este proceso de selección es que las bacterias o sus componentes subcelulares se hacen crecer in vitro. Sin embargo, el análisis genético ha demostrado que éstas expresan sólo una parte del genoma cuando se cultivan en el laboratorio. De hecho, muchos de los genes esenciales para la virulencia en los seres humanos se expresan solamente en vivo durante la infección. Por tanto, la selección crítica de las proteínas de bacterias cultivadas in vitro, no deberían expresarse únicamente en vivo. El concepto de que las bacterias cultivadas en vivo son diferentes de aquellas aisladas in vitro fue desarrollado por científicos como Henry Smith en la década de 1950. Ha ido tomando fuerza desde hace algunos años la idea de la existencia de genes específicos y sus productos que contribuyen a la infección, y éstos no necesitarían vida in vitro para su existencia.
David A. Rasko y colegas (Science 2008; 321(5892):1078-1080) evaluaron recientemente este modelo a través de un concepto de prueba experimental. Muchas bacterias utilizan sistemas de señalización de proteínas para “observar” su entorno, y estos mecanismos pueden “sentir” si las bacterias han entrado en un potencial hospedador. Algunos de los sensores se unen a pequeñas moléculas en el medio ambiente y, envían señales que alteran la expresión génica bacteriana. Las vías moleculares asociadas a estos sensores pueden activar los genes de virulencia en vivo.
Un ejemplo es el sistema de señalización Qse que se encuentra en muchos agentes patógenos bacterianos, incluyendo Escherichia coli enterohemorrágica (EHEC). Este método está controlado por un sensor de histidina quinasa asociado a membrana que responde a la presencia de señales adrenérgicas (por ejemplo, adrenalina o noradrenalina) del hospedador o a otras moléculas bacterianas. La unión específica a la proteína Qse causa auto-fosforilación y la transmisión de señales a través de una segunda proteína llamada QseB, que posteriormente genera aumentos en la expresión de los genes de virulencia.
Ya que es difícil obtener grandes cantidades de bacterias cultivadas in vivo, los autores diseñaron un ingenioso método que utiliza genes marcadores o reporteros conectados a genes de virulencia que a su vez son activados por el sistema regulador quórum sensing (Qse) de E. coli (figura 1). A continuación, se seleccionó una librería y se identificó un producto químico llamado LED209, que impide la activación de las secuencias reporteras e inhibe la unión de la noradrenalina a la proteína receptora QseC. Los autores fueron capaces de evaluar la capacidad de LED209 para impedir la unión de EHEC a las células del huésped y prevenir la infección de conejos por EHEC de las bacterias. En concentraciones nanomolares, LED209 fue eficaz en la prevención de la unión celular, pero no en la prevención de las infecciones. Sin embargo, LED209 demostró tener eficacia en otros dos modelos en vivo que involucraban la infección de ratones con Salmonella typhimurium o Francisella tularensis. LED209 no interfirió con la señalización adrenérgica del anfitrión.
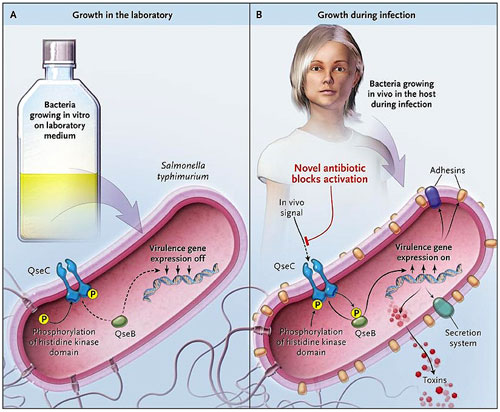
Las bacterias expresan algunos de sus genes de virulencia sólo durante la infección y no cuando son cultivadas in vitro. D. Rasko y colaboradores recientemente analizaron este comportamiento para diseñar un nuevo antibiótico, que detiene la infección por Salmonella typhimurium o Francisella tularensis en ratones, pero no elimina las bacterias cuando éstas se cultivan en el laboratorio. La forma ovalada de color rosa representa el desarrollo bacteriano, y los círculos pequeños las posiciones de las principales proteínas en la vía de señalización descrita por el grupo de Rasko. P señala la fosforilación del dominio quinasa. Las proteínas de virulencia (adesinas, toxinas y los sistemas de secreción) sólo se consideraron en bacterias cultivadas en vivo.
Evidentemente, estas investigaciones se encuentran al comienzo de un largo recorrido hacia el desarrollo de antibióticos, pero han establecido varios precedentes importantes que merecen la realización de exámenes más detallados. Quizá la propiedad más notable de LED209 es que a pesar de que puede atenuar la virulencia bacteriana en un hospedador, no inhibe su crecimiento normal en un medio de laboratorio. Esta es una característica interesante con muchas implicaciones, sin embargo, plantea notables desafíos para la industria. ¿Cómo va la creación de cribados para los exámenes rutinarios de actividad antimicrobiana de esta molécula para que la manipulación genética o incluso el cultivo sea un desafío? ¿Cómo crear cultivos para la aparición de resistencias? ¿Existe el peligro de que los mutantes surjan en situaciones en las que los genes de virulencia “despierten”, y cuáles serían las consecuencias de ese efecto, si los hubiere?
Fuente bibliográfica
Does the Trojan Horse Have an Achilles' Heel?
Gordon Dougan, D.Phil.
Wellcome Trust Sanger Institute, Genome Campus, Hinxton, Cambridge, United Kingdom.
N Engl J Med. 2009 Jan 1;360(1):83-4.