Ratones para la distrofia muscular
La mortalidad de los pacientes que padecen neumonía y afectación multiorgánica causada por el virus de la influenza (H5N1) varía entre 45% y 81%. El uso de oseltamivir no ha reducido la mortalidad asociada a este virus. Los insatisfactorios resultados se atribuyen a deficiencias ya sea en administración de antivirales o a la inducción de una severa tormenta de citoquinas, una poco frecuente pero grave respuesta inmunológica que se produce en el organismo. La escasa respuesta al medicamento también puede ser el resultado de un inicio tardío del tratamiento debido a las iniciales manifestaciones inespecíficas de la infección por el virus, de alta carga viral inicial, la mala biodisponibilidad oral del oseltamivir en enfermos graves, la falta de formas intravenosas y la aparición de resistencia durante el tratamiento. Los intentos de utilizar corticosteroides antiinflamatorios para controlar el exceso de inflamación se han asociado con efectos secundarios graves sin ningún tipo de mejoría en la supervivencia.
Por lo tanto, existe una necesidad urgente de encontrar un tratamiento eficaz en la lucha contra la infección por el virus H5N1 en seres humanos debido a la importante mortalidad asociada a este agente.
Terapia celular y distrofia muscular
La distrofia muscular de Duchenne es una enfermedad devastadora, progresiva y ligada al cromosoma X que produce degeneración muscular. Es la forma más común de distrofia muscular, que afecta a 1 de cada 3500 niños. Comienza en la primera infancia para avanzar a la fase final en donde se caracteriza por el fallo cardiorrespiratorio y la muerte, que usualmente ocurre en la adolescencia o principios de los años 20. La condición ataca a los músculos estriados de las extremidades, al diafragma y al corazón y se asocia con una pérdida progresiva de la masa muscular, lo que lleva a problemas de movimiento y parálisis. Las miofibras esqueléticas degeneran y se produce necrosis; los músculos acumulan depósitos de calcio y se sustituyen por tejido conjuntivo y grasa.
Se sabe, desde hace unos veinte años, que las mutaciones en el gen de la distrofina son responsables de la condición. Estas alteraciones conducen a la producción de proteínas estructurales defectuosas y a la pérdida de integridad de la membrana muscular. No existe un tratamiento efectivo disponible, a pesar de las intervenciones que incluyen agentes farmacológicos y modificaciones genéticas para sustituir la falta de distrofina.
Una alternativa atractiva es la terapia celular, y un reciente estudio descrito por Maximiliano Cerletti y colaboradores (Cell 2008; 134:37-47) demostró una interesante estrategia. El músculo está compuesto de células multinucleadas, llamadas miofibras, las cuales se unen a precursores miogénicos. Si estos precursores interactúan con un gen saludable, podrían facilitar la recuperación de la distrofina anómala y reparar la fibra mediante la formación de tejido y retomar la biología normal del músculo. Varias estrategias celulares han sido probadas con éxito variable.
Los mioblastos mononucleados miogénicos son los precursores capaces de la proliferación y fusión para formar fibras multinucleadas en cultivo de tejidos. El descubrimiento de los métodos para su purificación ha dado lugar a varios ensayos clínicos. A pesar de que las células humanas inyectadas se fusionan con las fibras musculares residentes y sintetizan los productos génicos en los músculos de los pacientes, los resultados siguen siendo muy localizados.
Dadas las limitaciones inherentes de este origen natural de células musculares, los investigadores han recurrido a otras fuentes de células y modos de entrega. Las unidades estromas de la médula ósea se encuentran entre los tipos celulares que han sido aislados sobre la base de sus propiedades adhesivas. Éstas pueden ser replicadas en gran medida en los cultivo de tejidos, proporcionando una amplia fuente de células capaces de contribuir a los músculos de ratones mdx (un modelo para la distrofia muscular de Duchenne), después de la inyección intramuscular. En otro enfoque, las células con una liberación muy activa pueden ser aisladas de sangre o de músculo por citometría de flujo. Una característica atractiva es que pueden ser inyectadas por vía intravenosa, ya que son capaces de extravasarse de la vasculatura e integrarse dentro de las miofibras después de la inyección. La limitación es que no pueden ser reproducidas en cultivos de tejidos. Se ha observado un trasplante eficiente con el uso de otro tipo de células, los mesoangioblastos (células madre adultas que se localizan en pequeños vasos sanguíneos del tejido muscular), que pueden ser replicados eficientemente en cultivos y efectivamente entregados por caterización arteria femoral. Los mesoangioblastos se aíslan de vasos pequeños a partir de biopsias de tejido muscular. Estas células tienen la ventaja de aportar a todos los músculos del cuerpo y se ha demostrado que restauran la distrofina y la fuerza muscular en perros distróficos.
En paralelo, los investigadores están cada vez más interesados en las células satélite, que son propias del músculo esquelético y fuente natural de células para la regeneración muscular. Hace más de cuatro décadas, Alexander Mauro identificó por primera vez células satélite utilizando la microscopía electrónica de células mononucleadas enfundadas en su propia membrana a lo largo de la longitud de la fibra muscular. Recientemente, su aislamiento se ha logrado con el uso de distintos protocolos. Sorprendentemente, si las células satélite son trasplantadas en el momento en que se encuentran aisladas, son capaces de diseminarse ampliamente en todo el músculo en el que se inyectan, una propiedad que se pierde tan pronto como están expuestas a condiciones de cultivo, dando lugar a mioblastos más especializados.
El estudio de M. Cerletti y colegas representa un avance en varios aspectos. Los autores describen una subpoblación de células satélite aisladas obtenidas con el uso de una combinación de marcadores moleculares, de los cuales CXCR4 (un receptor que responde a las señales emitidas por daño muscular). Genéticamente marcados, los progenitores del músculo esquelético, que expresan la proteína verde fluorescente (GFP), pueden ser recuperados de los músculos a los que contribuyen (Figura 1). Utilizando un sistema de doble marcado, los investigadores demostraron que las células contribuyen no sólo a las fibras musculares preexistentes, sino también a las fibras recién formadas. Notablemente, la mayoría de las células satélite de esta subpoblación aportaron sustancialmente a los músculos inyectados (los autores observaron que el 90% de las fibras musculares se componían de células marcadas con GFP) generando un aumento sin precedentes en la fuerza muscular de ratones mdx.
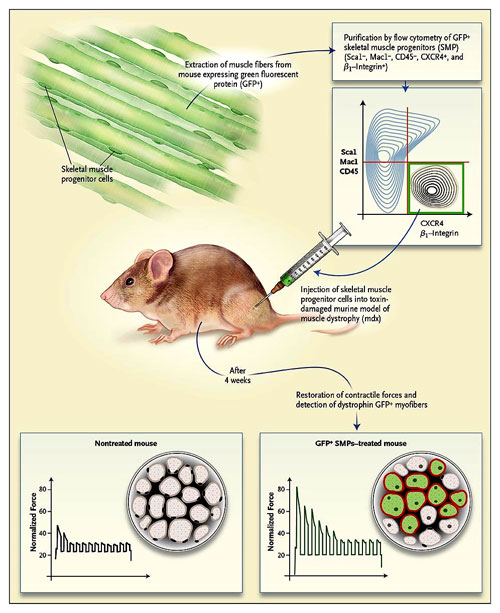
Maximiliano Cerletti y colegas aislaron progenitores del músculo esquelético (SMP) de ratón a partir de animales transgénicos que expresaban la proteína verde fluorescente (GFP+) de músculos esqueléticos y enriquecieron estas células por citometría de flujo utilizando anticuerpos contra marcadores de la superficie celular. Se observó que después de la inyección de células purificadas en músculos dañados por toxinas o que genéticamente eran deficientes (MDX), las células potenciaron a más del 95% de las fibras musculares y restauraron la expresión y función de la distrofina, demostrado por el aumento de la fuerza (la relación entre la fuerza máxima y el área muscular) ejercida por la supresión del músculo soleo (imágenes inferiores).
¿Son los progenitores CXCR4+ del músculo esquelético u otras células satélite las células madre del músculo adulto? Para que así sea, es necesario cumplir con criterios uniformes. Una sola célula debe ser trasplantada, reproducida y dar lugar a progenie más especializada. Es necesario un medio de propagación celular en cultivo sin pérdida de sus propiedades de regeneración, sin la multiplicación, un bajo número de células limitaría las aplicaciones terapéuticas en relación con la inmunosupresión. Por otra parte, si la liberación sistemática es posible, no sería necesario inyectar cada músculo por separado. Por último, falta por identificar la contrapartida humana de las células satélite especializadas y demostrar que tienen similares propiedades. No obstante, las conclusiones del grupo de Cerletti son notables y, sin duda, tremendamente interesantes, especialmente en la terapia de la distrofia muscular de Duchenne.
Fuente bibliográfica
Cell Therapies for Muscular Dystrophy
Helen M. Blau, Ph.D.
Stanford University School of Medicine, Stanford, CA, USA.
N Engl J Med. 2008 Sep 25;359(13):1403-5