IgG, patógena y terapéutica a la vez
La inmunoglobulina intravenosa (IVIG) es un complejo de anticuerpos de IgG hecho de plasma humano y sólo ha sido aprobada para tratar algunas condiciones muy determinadas; sin embargo, se utiliza con éxito en pacientes con lupus, artritis, asma y púrpura trombocitopénica, entre otros desórdenes autoinmunes. Los anticuerpos actúan como parte de la inmunorespuesta para identificar y desactivar a los agentes externos. El problema es que comienzan a atacar las propias células del cuerpo, de hecho, las mismas inmunoglobulinas protectoras pueden causar tales trastornos inmunorregulatorios. Pero, cuando la IVIG se infunde en los pacientes, ellos mejoran notablemente de su inflamación.
A esto se la he denominado la paradoja de la IgG. ¿Pero por qué la IVIG posee tal eficacia?: simple, una pequeña fracción de los anticuerpos de IgG lleva un azúcar llamado ácido siálico, que fundamental concede la capacidad protectora. Cuando los investigadores han quitado el ácido siálico, la molécula conserva su estructura y período, pero pierde sus capacidades beneficiosas. Ésta es una condición muy interesante, ya que la IgG puede cambiar de un estado que es absolutamente inflamatorio a uno activamente antiinflamatorio apenas alterando la posición de un azúcar. Este descubrimiento tiene implicaciones potencialmente enormes, y ahora se está trabajando para generar una forma recombinante de IgG que, en virtud de un ácido sialico unido en el lugar correcto, sea antiinflamatoria y actuar como tratamiento en los desórdenes autoinmunes.
Efecto antiinflamatorio de la IgG
La inmunoglobulina intravenosa es una preparación terapéutica producida de IgG policlonal humana a partir de un conjunto de plasmas provenientes de miles de donantes sanos. Inicialmente utilizada en el manejo de deficiencias inmunológicas primarias y secundarias, la IGIV se utiliza cada vez más en diversas enfermedades inflamatorias sistémicas y autoinmunes, incluyendo la trombocitopenia inmune, el síndrome de Guillain-Barré, polineuropatía desmielinizante inflamatoria crónica, la miastenia gravis, dermatomiositis y el síndrome de Kawasaki.
Se han sugerido varios mecanismos para explicar los efectos beneficiosos de inmunoglobulina intravenosa en los pacientes. Uno de esos procesos fue propuesto por Ravetch y colaboradores el 2006: que su efecto beneficioso está mediado principalmente por una fracción de anticuerpos con un ácido siálico terminal en el complejo asparagina-glicano en la posición 297 (Asn297) de la región constante (Fc) de la IgG (figura 1, recuadro). La fracción de la IGIV rica en estos ácidos siálicos que contienen anticuerpos muestran un efecto antiinflamatorio, mejorando la expresión del inhibidor del receptor IgG Fc IIB y eliminando la acción enzimática de los residuos del ácido siálico que contrarrestan este efecto antiinflamatorio.
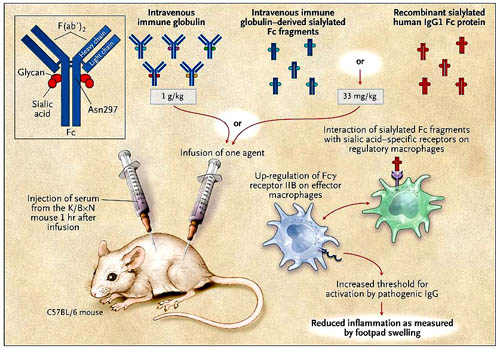
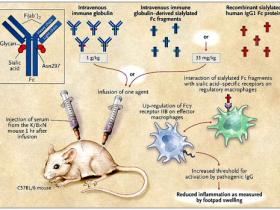
Mediante el uso del modelo murino K/BxN para la artritis, R. M. Anthony y colaboradores encontraron que tanto la proteína recombinante humana IgG1 Fc 2,6-sialilada como los fragmentos derivados de la IGIV y enriquecidos con ácido siálico tienen un efecto antiinflamatorio similar al de la inmunoglobulina intravenosa intacta. La molécula de IgG (recuadro) es el principal componente de la inmunoglobulina intravenosa y el residuo Asn297 puede ser glicosilado. Los autores sugieren que la proteína recombinante IgG1 Fc sialilada interactúa con la regulación de los macrófagos. Estos aumentan la expresión del receptor Fc gamma IIB en la superficie de los macrófagos efectores que, a su vez, determinan el límite necesario para que la IgG patógena ajuste la activación de los receptores Fc gamma y pongan en marcha el proceso inflamatorio.
En un estudio más reciente, R. M. Anthony y colegas (Science 2008; 320:373-6) dilucidaron el papel de la inmunoglobulina intravenosa y su actividad antiinflamatoria dependiente de ácido siálico. Al analizar los glicanos por medio de espectrometría de masa secuencial se observó una vinculación preferencial de la unión 2,6-sialilada a Asn297 que promueve la actividad antiinflamatoria. Por otra parte, los autores reconstituyeron la actividad antiinflamatoria de los fragmentos Fc sialilados de la inmunoglobulina intravenosa, usando una proteína recombinante humana IgG1 Fc completamente 2,6-sialilada. Esta molécula mostró actividad antiinflamatoria similar a la derivada de IgG en un modelo murino de artritis con fragmentos Fc enriquecidos con ácido siálico (figura 1).
Las moléculas IgG Fc sialiladas (derivadas de cualquiera inmunoglobulina intravenosa o IgG1 humana recombinante) fueron administradas en ratones C57BL/6 1 hora antes de la inyección de suero (con anticuerpos inductores de artritis) proveniente de ratones transgénicos K/BxN, y entonces se observó la hinchazón de los pies durante los próximos 7 días para evaluar los resultados clínicos de la enfermedad. Cada preparación de IgG Fc sialilada impidió la hinchazón cuando se administraban en dosis bajas (33 mg por kilogramo de peso corporal para las preparaciones Fc versus 1 g por kilogramo de IGIV). Estos hallazgos sugieren que la molécula IgG Fc 2,6-sialilada es un componente biológicamente activo de la inmunoglobulina intravenosa, por lo menos en este modelo experimental de artritis reumatoide.
¿Cuáles son los mecanismos de acción de la proteína recombinante IgG Fc sialilada? No son conocidos. Anthony y colaboradores describieron un modelo (figura 1) donde la proteína interactúa con un receptor específico para la regulación de los macrófagos en la zona marginal del bazo. Este tipo de regulación aumenta la expresión del receptor Fc gamma IIB en macrófagos efectores. La acción, a su vez, eleva el umbral necesario para que la IgG patógena active la señalización a través de los receptores Fc gamma y, por tanto, se desencadenen los procesos inflamatorios. Sin embargo, los resultados de algunos estudios son incompatibles con el presente mecanismo propuesto, ya que no se ha determinado si los receptores Fc gamma tienen un papel crucial en la mediación del efecto terapéutico de la inmunoglobulina intravenosa.
¿Este hallazgo cambiará el uso de la inmunoglobulina intravenosa en la práctica clínica? Probablemente no en los pacientes con inmunodeficiencias como la agammaglobulinemia ligada al cromosoma X o la inmunodeficiencia variable común, ya que estas personas necesitan toda la IgG dispuesta en la IGIV para combatir las infecciones repetitivas. En contraste, el estudio del grupo de Anthony sí afecta el tratamiento de los pacientes con ciertas enfermedades autoinmunes, en particular, con trombocitopenia inmune. Los resultados de modelos experimentales y ensayos clínicos han demostrado el efecto antiinflamatorio de los fragmentos Fc de la inmunoglobulina intravenosa, lo que sugiere un determinado rol para los receptores Fc gamma en la patogénesis de la enfermedad. Si la proteína recombinante IgG Fc sialilada muestra beneficios en pacientes con trombocitopenia inmune similares a la demostrado en roedores, podría llegar a ser posible evitar la infusión de grandes cantidades de inmunoglobulina intravenosa. Otro beneficio podría ser la eliminación de la variación entre lotes de una determinada preparación y entre preparaciones. También se minimizaría el riesgo de contaminación por agentes infecciosos emergentes y re-emergentes.
A pesar de los prometedores resultados obtenidos en los modelos experimentales, terapias con la proteína recombinante pueden causar reacciones adversas en los pacientes. Debido que se han descrito respuestas inmunes contra las proteínas recombinantes, el uso terapéutico de la proteína recombinante IgG Fc sialilada debe ser considerado con cautela. A pesar de la heterogeneidad en la patogénesis y presentación de las enfermedades inflamatorias y autoinmunes, parece poco probable que la proteína recombinante IgG Fc sialilada por sí sola sea consistentemente efectiva en todos los grupos de individuos que actualmente perciben beneficios de la IGIV. Dicho esto, ensayos clínicos de fase 1 podrían ahora ser considerados en las enfermedades autoinmunes para poder demostrar que los receptores Fc gamma tienen un papel determinado en la patogénesis y los fragmentos Fc de la inmunoglobulina intravenosa son beneficiosos.
Fuente bibliográfica
The Antiinflammatory IgG
Srini V. Kaveri, D.V.M., Ph.D., Sébastien Lacroix-Desmazes, Ph.D., and Jagadeesh Bayry, D.V.M., Ph.D.
Institut National de la Santé et de la Recherche Médicale, Université Pierre et Marie Curie, Université Paris Descartes, Centre de Recherche des Cordeliers, Paris.
N Engl J Med. 2008 Jul 17;359(3):307-9