Mucosa intestinal, un buen escondite para el VIH
Se sabe que la infección con el virus de la inmunodeficiencia humana 1 (VIH-1) invade rápidamente los nódulos y los tejidos linfáticos que abundan en el intestino. El VIH se reproduce primero allí y luego destruye las células inmunológicas CD4 del tejido linfático, lo que contribuye a la disfunción inmunológica. La migración de linfocitos al tejido linfoide asociado al intestino está mediada por la integrina alfa-4-beta-7. También se ha demostrado que la proteína gp120, que envuelve al VIH-1, se vincula a una forma activa de alpha4beta7. Esta interacción está regulada por un tripéptido en el bucle V2 de gp120, un péptido que imita estructuras presentes en los ligandos naturales de la integrina alfa-4-beta-7. En las células T CD4, la unión de la alfa-4-beta-7 y de la gp120 tiene como consecuencia una rápida activación de la LFA-1, otra integrina, la cual está implicada en el establecimiento de sinapsis virológicas, facilitando una eficiente proliferación del VIH a través de las células.
Hoy en día, los investigadores están interesados en describir receptores porque ofrecen blancos más concretos para el desarrollo de nuevos fármacos contra la enfermedad, ya que los intentos de controlar el VIH por estimulación del sistema inmunitario del cuerpo han fracasado.
Integrinas, VIH y sistema inmunitario
Aunque en ausencia de tratamiento, el síndrome de inmunodeficiencia adquirida (SIDA) generalmente se desarrolla de 8 a 10 años después de la infección con el virus de inmunodeficiencia humana (VIH) tipo 1 (VIH-1), su arremetida en el sistema inmunológico comienza con la rápida disminución de memoria de las células T CD4+, la mayoría de los cuales residen en el intestino. Un reciente informe de James Arthos y colaboradores (Nat Immunol 2008; 9:301-9) sugiere que el VIH-1 es capaz de controlar la caída de los linfocitos T CD4+, en parte, al intervenir la molécula que apoya directamente a las células T del tubo digestivo: la integrina alfa-4-beta-7.
Aunque el agotamiento celular de T CD4+ está reflejado en última instancia (y clínicamente medido) como la disminución de los linfocitos T CD4+ circulantes, su análisis en sangre proporciona una evaluación imperfecta de la cantidad total, ya que solamente entre 1 y el 2% se encuentra en la sangre periférica. Se cree que un 30% o más de todas las células T residen en la mucosa, en particular, en el intestino.
Los estudios realizados en primates no humanos infectados con el virus de inmunodeficiencia símica (VIS), y confirmados posteriormente en personas infectadas con el VIH-1, han demostrado que la infección primaria induce un rápido y profundo agotamiento de las células T CD4+ en el tracto gastrointestinal. Los mecanismos mediante los cuales se produce esta caída siguen siendo controvertidos. La infección directa parece tener un papel importante: de un 30 a un 60% de los linfocitos T CD4+ son células contagiadas con el VIS 10 días después de la infección del hospedador. Sin embargo, también es probable que los mecanismos indirectos resultantes de la apoptosis en células no infectadas participen en la destrucción de los T CD4+ en células del tubo digestivo.
Varios mecanismos parecen dar cuenta de la predilección distintiva del VIH-1 y del VIS sobre las células T CD4+ intestinales. Ambos virus preferentemente se replican gracias a las células T CD4+ que tienen la memoria activada, que constituyen la mayoría de las unidades que residen en el tracto gastrointestinal. Los T CD4+ intestinales también expresan niveles relativamente elevados de receptores de quimiocinas CCR5, uno de los principales correceptores para la entrada del VIH-1 y SIV en las células T CD4+. Sin embargo, la capacidad de SIV para infectar T CD4+ que no expresan niveles detectables de CCR5 en su superficie y de infectar células que no expresan marcadores típicos de activación, señala que otros factores también regulan la inclinación del VIH-1 por las células T intestinales.
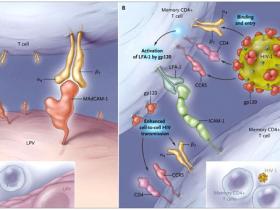
El grupo de J. Arthos describe una serie de experimentos que apoyan la hipótesis de que el VIH-1 es capaz de obligar al alojamiento intestinal de la molécula alfa-4-beta-7. La capacidad de los linfocitos a migrar a zonas específicas del cuerpo, tales como la piel o el intestino, está regulada en parte por moléculas de superficie que amarran a las células a “compañeros” moleculares expresados en el endotelio vascular. La integrina alfa-4-beta-7 ayuda a dirigir el tráfico de células T hacia el tubo digestivo mediante la unión a moléculas de adhesión expresadas por células endoteliales en los ganglios linfáticos mesentéricos y en la lámina propia intestinal (figura 1).
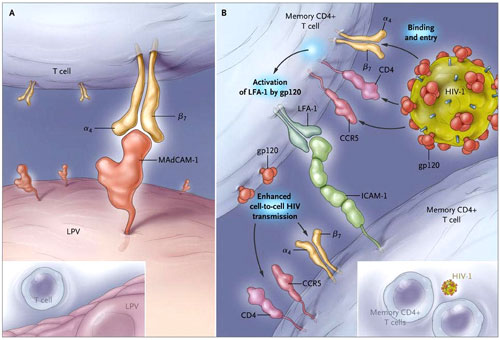
El alojamiento de las células T en el tubo digestivo se ve facilitado por la integrina alfa-4-beta-7 (panel A). La posterior unión de la integrina a la MAdCAM-1 (molécula de adhesión celular de adresina mucosal 1) media la unión de alfa-4-beta-7 a los linfocitos en las vénulas de endotelio alto (por ejemplo, la lámina de la vénula propia [LPV]) del tejido linfoide asociado con el intestino. La integrina alfa-4-beta-7 puede optar por facilitar la entrada y propagación del VIH-1 en el tejido linfoide asociado al intestino (panel B). Interacciones entre el bucle V2 del VIH-1 sobre la glicoproteína 120 (gp120) y alfa-4-beta-7 mejora la interacción del virus con la memoria de las células T CD4+ en del tubo digestivo y la posterior entrada celulalar a través de mecanismos dependientes de CD4 y del receptor de quimiocinas CCR5. La participación de alfa-4-beta-7 con la gp120 soluble o la gp120 de los viriones del VIH-1 o las células infectadas por VIH-1 genera la activación de LFA-1 (función del antígeno-1 del linfocito), aumentando la relación celular a través de interacciones de LFA-1 con la molécula de adhesión intercelular 1 (ICAM-1) y, por tanto, se incrementa la transmisión célula a célula del VIH-1.
Inicialmente impulsados por la inesperada observación de que el VIH puede unirse a las células asesinas naturales, los autores demostraron que alfa-4-beta-7 podría servir como una alternativa para que el VIH-1 cubriera la glicoproteína 120 (gp120). En base a la información existente sobre ciertos aminoácidos que median la unión de ligandos a alfa-4-beta-7, los autores pudieron identificar una región variable del bucle V2 del VIH que se une a alfa-4-beta-7. Sorprendentemente, los aminoácidos responsables para la unión de alfa-4-beta-7 (leucina-aspartato-valina, o LDV) están altamente conservados entre cepas del VIH-1, a pesar de que el bucle V2 es muy variable. La mutación de LDV afectó la capacidad del VIH para crecer en cultivos de linfocitos. Por último, la unión de VIH-1 a alfa-4-beta-7 también fue capaz de inducir la activación de otra integrina, la función del antígeno-1 del linfocito (LFA-1), que tiene un papel clave en las interacciones célula-célula. La LFA-1 facilita la formación de enlaces entre los linfocitos que pueden desempeñar un papel importante en la transmisión del VIH entre células. Por lo tanto, la unión del VIH-1 sobre alfa-4-beta-7 puede ser capaz de inducir la activación celular que mejora aún más la eficiencia de la propagación del VIH-1 a partir de una célula a otra.
Aunque el estudio de Arthos y colegas proporciona pruebas concluyentes de una interacción bidireccional entre el VIH-1 y alfa-4-beta-7, es necesario realizar más experimentos para entender si la predilección del VIH por los linfocitos intestinales se debe principalmente a las interacciones entre alfa-4-beta-7 y la gp120. La infección de monos con cepas recombinantes del VIS debe proporcionar información definitiva sobre la importancia in vivo de la interacción entre gp120 y alfa-4-beta-7. Si la trascendencia de esta interacción se confirma, puede ser útil diseñar pequeñas moléculas antagonistas para las interacciones entre gp120 y alfa-4-beta-7 respecto a terapias coadyuvantes. Por otra parte, la inducción de respuestas de anticuerpos contra V2, la cual debería interrumpir la capacidad del virus para replicarse en las células T CD4+ intestinales, podría ser una solución más viable que la generación de anticuerpos neutralizantes contra el VIH, lo que frustrantemente ha sido difícil de generar a través de la vacunación. Sin embargo, los esfuerzos para explotar las múltiples interacciones del VIH con el sistema inmunológico probablemente se vea complicado por la variabilidad de los aminoácidos que rodean las zonas conservadas responsables para la unión de alfa-4-beta-7.
Fuente bibliográfica
How HIV guts the immune system
R. Paul Johnson, M.D.
New England Primate Research Center, Harvard Medical School, Southborough, MA, USA.
N Engl J Med. 2008 May 22; 358(21):2287-9