Nefropatía diabética
El glomérulo y sus problemas
La diabetes es la causa más frecuente de insuficiencia renal. La incidencia de nefropatía difiere entre los 2 tipos principales. Los diabéticos tipo 1 tienen una probabilidad de 30 a 40 % de desarrollar la condición después de 20 años, a diferencia de la incidencia mucho menor en los pacientes tipo 2 en quienes sólo cerca del 15 al 20 % desarrolla enfermedad renal. La nefropatía diabética se manifiesta inicialmente por una proteinuria, luego conforme declina la función renal se acumulan urea y creatinina en la sangre. Esto va acompañado de otras complicaciones como la hipertensión, la retinopatía y cambios vasculares. La alteración puede estar presente durante muchos años antes de que se desarrolle un síndrome nefrótico o una insuficiencia renal. Se diagnostica con un urianálisis de rutina que muestra proteína en la orina. Su tratamiento convencional implica el uso de antihipertensivos inhibidores de la ECA y en la nefropatía progresiva se utiliza la diálisis y el transplante de riñón.
La proteína C activada (PCA) es una vitamina K endógena dependiente de las proteasas de serina y se activa por el complejo trombina-trombomodulina. La PCA presenta múltiples actividades biológicas, incluyendo la anti-coagulación, anti-inflamación y la lucha contra la apoptosis. A su vez, la nefropatía diabética es causada por el daño al glomérulo capilar debido a la muerte celular programada inducida por la hiperglucemia. Es escasa la investigación actualizada que proporcione una directa evidencia del vínculo causal entre la disfunción endotelial, la enfermedad microvascular de la diabetes y el deterioro de órganos diana.
Este presente análisis nos muestra que la formación de proteína C activada, regulada por la trombomodulina endotelial, se encuentra minimizada en ratones diabéticos y causalmente está relacionada con las nefropatías. La PCA dependiente de trombomodulina regula la citoprotección en la nefropatía diabética mediante la inhibición de la apoptosis glomerular. Además, la PCA impide la apoptosis generada por la glucosa en las células endoteliales y en los podocitos, los componentes celulares de la barrera de filtración glomerular. Los experimentos establecen un nuevo camino en la que la hiperglucemia dificulta la formación de la PCA dependiente de trombomodulina endotelial. La pérdida de formación interrumpe la “comunicación” entre el compartimento vascular y los podocitos, causando apoptosis glomerular y nefropatía diabética. Por el contrario, el mantenimiento de elevados niveles de PCA durante la diabetes a largo plazo protege contra la enfermedad.
Proteína C activada y nefropatía diabética
A los estudiantes de medicina se les enseña que la disfunción endotelial es importantísima en la fisiopatología de la enfermedad microvascular diabética, en especial los defectos glomerulares que son característicos de la nefropatía diabética. Sin embargo, los hechos demuestran la escasez de conocimientos sobre la biología molecular del glomérulo en las personas con diabetes tipo 1 ó 2. ¿Qué genes se activan en las células endoteliales glomerulares de los pacientes diabéticos? ¿Qué genes están anormalmente reprimidos? El alcance de nuestra ignorancia es impresionante. Afortunadamente, un estudio recientemente publicado por Berend Isermann y colaboradores (Nat Med 2007; 13:1349-58), subsana, al menos en parte, este déficit.
Como consecuencia de su singular posición entre dos conjuntos de arteriolas, las células endoteliales glomerulares están expuestas a muy altas presiones hidráulicas, sobre todo en comparación a las de capilaridad más plana. La fuerte fuerza de fricción de la circulación, el elevado coeficiente de ultrafiltración y la alta presión de oxígeno en el lumen también afectan a este lecho vascular. Estas presiones pueden ser exacerbadas por una serie de cambios que incluyen la transmisión de la hipertensión sistémica en el glomérulo y el incremento de la producción de estímulos nocivos, tales como la angiotensina II, las especies reactivas de oxígeno y nitrógeno y los productos finales de la glicación, todos característicos del entorno diabético.
Sin embargo, la célula endotelial glomerular no están tan sola. Por ejemplo, el factor de crecimiento endotelial vascular (VEGF, por sus siglas en ingles), producido constitutivamente y en abundancia por los podocitos, de alguna manera atraviesa la membrana basal glomerular y protege a las células endoteliales contra la apoptosis. La desprotección está asociada a la enfermedad; se ha encontrado el receptor soluble VEGF 1 (también llamado soluble fms-like tirosina-quinasa 1) en pacientes con preeclampsia.
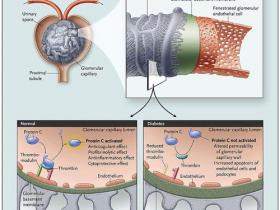
La proteína C activada igualmente protege las células endoteliales glomerulares contra la apoptosis. Ésta se activa por la unión de la trombina (un producto de la cascada de coagulación) a su receptor, la trombomodulina, en la superficie de las células endoteliales glomerulares (figura 1). Debido a que este complejo cataliza la activación de la proteína C, tiene un papel clave en la interfaz entre el endotelio y la sangre. La proteína C activa posee potentes efectos antitrombóticos y pleiotrópicos, citoprotectivos, fibrinolíticos y propiedades antiinflamatorias. El estudio del grupo de B. Isermann sugiere que la nefropatía diabética se asocia con la reducción de la producción glomerular y la acción de la proteína C activada.
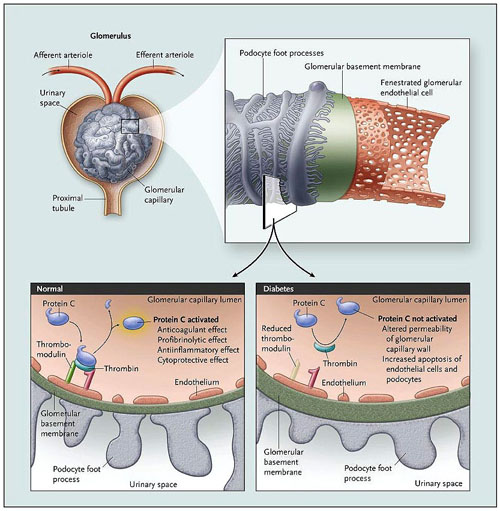
La proteína C se activada por la unión de la trombina a su receptor - trombomodulina - en la superficie de las células endoteliales glomerulares. Se produce un ultrafiltrado de sangre a través de la pared capilar glomerular, que está formada por células endoteliales, la membrana basal y células epiteliales glomerulares (o podocitos). La trombomodulina forma un complejo de alta afinidad con la trombina, el producto de la cascada de coagulación. Este complejo cataliza la conversión de la proteína C a su forma activa, con un potente efecto anticoagulante, profibrinolítico, antiinflamatorio y citoprotectivo. En la nefropatía diabética, la producción de proteína C activada en el glomérulo es anormal, en parte a causa de la represión de la expresión de trombomodulina inducida por la hiperglucemia. La disminución de la actividad funcional de la proteína afecta a la permeabilidad de la capilaridad glomerular de la pared y aumenta la apoptosis de las células endoteliales glomerulares y de los podocitos. Por lo tanto, esto puede ser relevante en la fisiopatología de la nefropatía diabética.
La proteína C activa recombinante reduce la mortalidad entre los adultos con sepsis grave; su administración farmacológica posiblemente compensa la deficiencia funcional. Dado su efecto anticoagulante, no es de extrañar el riesgo de hemorragia, en todo caso, este rol fundamental en la microvasculatura de pacientes con sepsis, no se lo esperaba la mayoría de los investigadores.
Isermann y colaboradores reportaron que la trombomodulina se expresa fuertemente en el glomérulo de ratones tipo salvaje. Su ARN mensajero y los niveles de proteína, además de la producción de proteína C activa, estaban crónicamente agotados en los glomérulos de ratones con diabetes mellitus inducida por estreptozotocina. Este hallazgo es una reminiscencia de los vasos sanguíneos en la sepsis aguda. Utilizando ratones genéticamente manipulados, los investigadores eliminaron las vías que involucraban a la proteína C activa y que eran pertinentes para la nefropatía diabética. Entonces, ellos estudiaron los ratones en que la activación de la proteína C dependiente de trombomodulina era afectada. Después de 26 semanas, estos animales tenían significativamente peor proteinuria y acumulación de matriz extracelular glomerular que los ratones de tipo salvaje con diabetes. En contraste, no se desarrollaron las manifestaciones estructurales y funcionales de la nefropatía diabética en los animales transgénicos portadores de una potente forma de activación de la proteína C. Además, sus células endoteliales glomerulares y podocitos sufrieron la apoptosis a un ritmo menor que aquellos ratones con la activación de la proteína C bloqueada.
Una reducción de la capacidad para generar proteína C activa en los glomérulos de los animales con diabetes puede predecirse por el aumento y la acumulación local de fibrina y trombina. La deposición de fibrina en la microvasculatura glomerular produce inflamación y coagulación. Isermann y colegas observaron que el tratamiento con heparina de bajo peso molecular (enoxaparina) aumentaba la nefropatía diabética en sus modelos. Esto es sorprendente, dado que la heparina debería prever la disminución de la producción local de trombina, sugiriendo que las propiedades anticoagulantes de la proteína C activa no son esenciales para su efecto protector en el glomérulo.
Aún hay que determinar la posible extrapolación de la acción de la proteína C activa en el modelo de ratón a los humanos. Independientemente, el estudio inspira una revisión de nuestra actual comprensión de cómo se desarrolla la nefropatía diabética. En las personas con diabetes, la expansión del soporte mesangial y la pérdida de la superficie de filtración capilar se correlacionan estrechamente con una disminución de la tasa de filtración glomerular. Las conclusiones de Isermann y colaboradores indican otro escenario: la pérdida de células endoteliales glomerulares, causada en parte por la reducción de la concentración de proteína C activa, genera lesiones, así como la expansión mesangial como respuesta al daño. Además, la apoptosis también puede causar el daño celular del epitelio glomerular, con el empeoramiento de la proteinuria en pacientes con nefropatía diabética.
Fuente bibliográfica
Activated Protein C and Diabetic Nephropathy
Richard E. Gilbert, M.D., and Philip A. Marsden, M.D.
Keenan Research Centre of the Li Ka Shing Knowledge Institute and the Division of Endocrinology, St. Michael's Hospital, Toronto.
N Engl J Med. 2008 Apr 10; 358(15):1628-30