Neurología
Un cuento sobre la proteína Tau
La enfermedad de Alzheimer (EA) es el desorden neurodegenerativo que con más frecuencia aflige a los ancianos, causando pérdida progresiva de la memoria y disfunción cognoscitiva. Es un problema creciente en el orden médico, psiquiátrico, neurológico, epidemiológico, social y económico, particularmente en países que tienen altas expectativas de vida. Neuropatológicamente, el cerebro con Alzheimer se caracteriza por el desarrollo de placas seniles, placas amiloideas compuestas principalmente por el péptido beta amiloide, βA, y de ovillos neurofibrilares, agregados hiperfosforilados de la proteína Tau. Sin embargo, también se dan otras alteraciones moleculares y neuroquímicas críticas. Por otra parte, los ratones transgénicos han probado ser altamente valiosos para evaluar posibles manejos medicamentosos en la EA. La evaluación de potenciales compuestos terapéuticos en modelos con ambos tipos de lesiones cerebrales es altamente deseable, pues un principio activo podría tener efectos opuestos sobre las proteínas βA y Tau.
La patología sigue siendo una ecuación con una gran cantidad de variables por resolver, sin embargo, la evidencia acumulada en los últimos 15 años está aproximando lentamente a la comunidad científica a lo que se vislumbra como una posible solución. De ella parece que participa la proteína Tau, cuya modificación anómala está implicada en la formación de estructuras aberrantes en el cerebro. Para los investigadores la cuestión clave estriba en descubrir qué fenómenos se asocian a esa pérdida de funcionalidad y cuál es su origen íntimo para tratar de revertir el proceso. Para el doctor Jesús Ávila, coordinador del grupo de Microtúbulos del Centro de Biología Molecular Severo Ochoa de la Universidad Autónoma de Madrid en España, “probablemente Tau es una de las explicaciones, pero la principal y única comprobada es envejecer”. La razón de ser de una patología como la EA tiene mucho que ver con la prolongación de las expectativas de vida lograda en los últimos años. “Convivimos desde que nacemos con la gran mayoría de nuestras neuronas”. A mayor edad, por tanto, mayor es el tiempo que la neurona está expuesta a factores de riesgo que puedan alterar su normal funcionamiento.
Entonces, ¿podría ser Tau la clave?
Tau, péptido beta amiloide y Alzheimer
Durante las próximas décadas, se cuadruplicará el número de pacientes con enfermedad de Alzheimer, la principal causa de demencia en los ancianos. A pesar de los notables avances realizados durante los últimos 20 años respecto a la comprensión de la genética y de la biología molecular del trastorno degenerativo, no existen avances terapéuticos capaces de alterar esta preocupante estadística. Un reciente y sorpresivo estudio llevado a cabo por Erik Roberson y colegas (Science. 2007 May 4; 316 (5825):750-4) es, por lo tanto, especialmente bien venido.
Previamente, los autores habían desarrollado ratones que expresaban una variante de la proteína precursor amiloidea humana codificada por un gen que llevaba dos mutaciones ligadas a la enfermedad de Alzheimer familiar precoz. Dicha proteína lanza el péptido beta amiloide, principal componente de las placas amiloideas que se acumulan en los cerebros de los pacientes con Alzheimer. Estos ratones se caracterizaban por sufrir alteraciones del comportamiento relativos a la edad, pérdida de memoria y presencia de placas amiloideas pero sin ovillos neurofibrilares. Además, algunos animales morían prematura y repentinamente.
En su estudio, el equipo de E. Roberson probó el efecto del agotamiento endógeno de Tau en el desarrollo de estas características. Tau es el principal elemento del ovillo neurofibrilar, otro sello neuropatológico de la enfermedad de Alzheimer. Los autores crearon ratones con un nivel reducido de la expresión de Tau mediante el cruzamiento de roedores con la proteína precursora amiloidea mutante con ratones en los cuales el gen Tau se encontraba inactivo (figura 1). La eliminación endógena de Tau no alteró la acumulación de placas amiloideas o la formación de neuritas distróficas que rodeaban las placas. Sin embargo, la reducción de Tau previno las alteraciones de comportamiento, la pérdida de memoria y la muerte repentina. Inesperadamente, los efectos positivos no requirieron la eliminación completa de Tau; mejoras significativas aún ocurrían cuando Tau era inactivado hasta en un 50%.
El estudio tiene importantes e intrigantes implicaciones no sólo para entender el mecanismo de disfunción cognoscitiva causado por βA sino que también para plantear estrategias terapéuticas. Los ensamblajes solubles de βA causan la pérdida de memoria y se unen a las espinas dendríticas, las estructuras postsinápticas que contienen los elementos dominantes de la formación de la memoria. Estos ensamblajes de βA, más que las placas neuríticas, deterioran cada vez más la cognición, aunque los caminos moleculares implicados todavía están lejos de dilucidarse. La idea que las placas neuríticas no tienen mayor efecto sobre la función cognoscitiva se refuerza por la observación que el comportamiento normal ocurre en presencia de estas placas en ratones con el gen Tau inhibido.
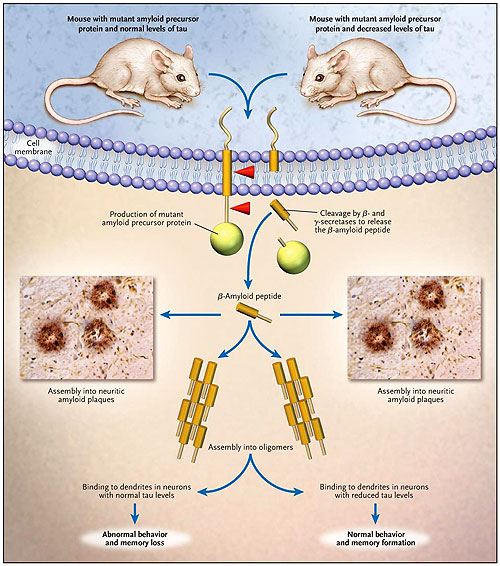
El estudio de Roberson y colegas sugiere que los efectos deletéreos del péptido beta amiloide sobre la memoria y la conducta pueden depender de la molécula Tau. Los autores redujeron genéticamente a Tau en ratones que sobre-expresaban el péptido beta amiloide. Los animales con niveles normales de la proteína demostraron pérdida de memoria relativa a la edad, anormalidades adaptativas y la formación de placa amiloidea. Los ratones con bajas concentraciones de Tau mostraron un típico patrón de acumulación amiloidea, pero no tenían pérdida de memoria o problemas de comportamiento. Los efectos patológicos del péptido beta amiloide pueden implicar la interrupción de la función sináptica. Sin embargo, se desconoce el papel exacto de Tau en la falla sináptica causada por la proteína βA .
Varias moléculas neuronales, muchas de las cuales interactúan con proteínas de las espinas dendríticas, median los efectos de βA sobre la memoria y la plasticidad sináptica. Ahora, Tau se une a este grupo de moléculas. La proteína normalmente reside en los axones, donde adosada a la tubulina promueve la polimerización y la estabilización de microtúbulos. Sin embargo, bajo condiciones patológicas, Tau obra recíprocamente con la molécula actina del citoesqueleto, un prótido que ayuda a promover cambios de forma de las espinas dendríticas y por lo tanto la plasticidad sináptica. Las espinas dendríticas también son el punto de entrada para la excitotoxicidad.
El trabajo de Roberson y colegas demostró que la muerte excitotóxica ocurrió sólo en los ratones que tenían niveles normales de Tau y que expresaban la proteína precursora amiloidea del mutante; los roedores con menos Tau eran más resistentes al colapso excitotóxico, llevando a los autores a especular que la proteína refuerza los efectos excitotóxico de βA. Aunque este resultado está en vías de aclararse y muestra que Tau regula la excitotoxicidad, como otras moléculas neuronales, todavía no hay pistas sobre el completo y satisfactorio mecanismo por el cual su disminución protege contra los problemas de conducta.
El hecho de que Tau facilita la disfunción cerebral regulada por βA y las excitotoxinas, y que incluso una reducción parcial de su nivel puede disminuir o prevenir fuertemente los efectos deletéreos, impulsa a Tau a un nivel muy elevado en la lista de candidatos terapéuticos, no sólo para la enfermedad de Alzheimer sino que también para condiciones neurológicas que implican excitotoxicidad, tal como el accidente vascular encefálico y la epilepsia. Esto apoya fuertemente que la reducción o la eliminación de Tau no tiene al parecer efectos negativos sobre el comportamiento y la memoria.
Sin embargo, es valido extrapolar los resultados de estos estudios en ratones a los seres humanos. Las respuestas compensatorias durante el desarrollo del cerebro que aparentemente previenen el déficit cognoscitivo en roedores se pudieron haber accionado por la reducción de Tau desde la concepción, una respuesta que no puede haber ocurrido si hubiese disminuido críticamente en los adultos. La sincronización de la reducción de Tau en los estadios de la enfermedad también puede ser crítica, según nos ha demostrado la experiencia con inhibidores de la excitotoxicidad producida por el glutamato. Ha sido inútil el uso en seres humanos de los antagonistas del receptor del glutamato después de una hemorragia cerebral aguda, a pesar de los efectos neuroprotectivos de tales drogas cuando se administran antes o inmediatamente después de la inducción de isquemia cerebral en modelos animales. Los ratones en el estudio del grupo de Roberson no tenían neurodegeneración, una característica muy marcada de la enfermedad de Alzheimer, así que los efectos clínicos óptimos se pudieron alcanzar solamente si Tau era reducido tempranamente, posiblemente antes del inicio de la neurodegeneración.
El estudio de Roberson y colaboradores subraya maravillosamente una potencial estrategia terapéutica: el bloqueo de las cascadas moleculares que gobiernan la formación y los efectos de βA y de las especies de Tau que interrumpen la función cerebral. Es hora de unificar los esfuerzos de investigación sobre el péptido beta amiloide y Tau respecto a la enfermedad de Alzheimer.
Fuente bibliográfica
A Tale about Tau
Karen H. Ashe, M.D., Ph.D.
Department of Neurology, University of Minnesota Medical School, Minneapolis, USA.
N Engl J Med. 2007 Aug 30;357(9):933-5