Genética médica
Terapia génica y los desafíos para la comunidad médica
Se cree que cada ser humano tiene cerca de 25.000 a 35.000 genes por célula. Una mutación, o el cambio, pueden dar lugar a una enfermedad, a una discapacidad física, o a un menor tiempo de vida. Estas mutaciones pueden pasar de una generación a otra y, en algunos casos, también pueden ocurrir espontáneamente, sin haberlas heredado de los padres. Con terapia génica, el tratamiento o la eliminación de las enfermedades adquiridas o de las condiciones físicas debido a mutaciones podrían convertirse en una realidad. Esta estrategia terapéutica implica la manipulación de los genes para luchar o prevenir enfermedades. En pocas palabras, se introduce un gen “bueno” en la persona que padece una enfermedad causada por un gen “malo”.
Más de 5000 patologías humanas se han atribuido a factores genéticos. La terapia génica conlleva el entusiasmo de poder “curarlo todo”, pero también la controversia que la rodea respecto a su capacidad de alterar los genes humanos y la promesa de un tipo de tratamiento médico que la mayor parte de las personas nunca se imaginaría. Con el potencial de eliminar y de prevenir enfermedades hereditarias tales como la fibrosis quística y la hemofilia, la terapia génica se está transformando en una potencial área de desarrollo médico, aplicable también al manejo de enfermedades actualmente incurables, como el SIDA, cánceres, determinadas patologías infecciosas (hepatitis, SIDA), cardiovasculares (hipercolesterolemia y aterosclerosis), enfermedades neurodegenerativas (Parkinson y Alzheimer) o enfermedades crónicas (artritis reumatoide).
En el caso de la pediatría, existe una considerable cantidad de riesgo implicada en los ensayos de esta clase de terapia y, hasta la fecha, sólo los niños que están seriamente enfermos o padecen patologías incurables por medios convencionales, se han considerado para estas investigaciones clínicas. En aquellas enfermedades más severas y que no responden a los tratamientos establecidos, sin embargo, este tipo de manejo puede ofrecer la esperanza de una intervención a corto plazo.
Dos tipos de terapia génica
1. Terapia génica somática
La terapia por transferencia génica en tejidos somáticos plantea cuestiones éticas muy limitadas, puesto que el éxito o el fracaso en el intento afectará sólo al paciente enfermo. El asunto entra dentro de las preocupaciones típicas en torno a cualquier tipo de experimentación con humanos, exactamente dentro del cálculo de beneficios y riesgos para el individuo.
Existe unanimidad en exigir una evaluación cuidadosa del riesgo que implica el uso de vectores virales, incluyendo su capacidad para infectar las líneas celulares del progenitor y el potencial daño colateral de la inserción. Las intervenciones sobre células somáticas (en el páncreas, por ejemplo, para combatir la diabetes) no afectan, en principio, a la dotación genética de la persona sometida a ellas, pues no intervienen en los procesos reproductores del ser humano.
Pero, desde el punto de vista jurídico, las células somáticas y sus componentes (incluidos los genéticos) forman parte de la integridad personal (física o psíquica del individuo), dentro de lo que se podría considerar como subcategoría de "integridad genética" y, por consiguiente, se benefician de la protección jurídico-penal otorgada a ese bien jurídico.
2. Terapia génica germinal
Por tratarse de una terapia que afecta no sólo al paciente (en este caso un embrión), sino, potencialmente, a toda su descendencia, el hablar de "terapia génica germinal" tiene grandes implicancias éticas y sociales.
La terapia de línea germinal se desarrolló por primera vez en ratones en 1983, cuando se introdujeron con éxito copias del gen de la hormona del crecimiento humano en los embriones mediante microinyección (el gen se inserta directamente en el interior del embrión utilizando una pequeña aguja). En la minoría de embriones en los que se integró la secuencia también se produjo una modificación de los gametos y el gen de la hormona se transmitió a las siguientes generaciones (los animales alcanzaban un tamaño anormalmente grande).
Aunque en principio la terapia de línea germinal es posible en los seres humanos, esta opción plantea importantes problemas. En primer lugar, los embriones inyectados suelen morir y algunos desarrollan tumores y malformaciones. En segundo lugar, incluso en un trastorno autosómico dominante, sólo la mitad de los embriones serán genéticamente normales.
Si fuese posible distinguir los embriones genéticamente normales (por ejemplo, mediante diagnósticos por PCR de productos fecundados in vitro), seria más fácil implantar embriones normales que alterar los anormales. Por ultimo, existen numerosas cuestiones éticas asociadas con la alteración permanente de la herencia genética humana. Por estos motivos, parece improbable que la terapia de la línea germinal humana sea útil o deseable.
Terapia génica del cáncer
En el cáncer, no se trata de corregir un defecto genético como ocurre en las enfermedades monogénicas, sino de utilizar la manipulación génica para dotar de una nueva propiedad a las células, que permite aprovecharlas en algún aspecto de la patología oncológica con fines terapéuticos. En la actualidad, se han desarrollado distintas estrategias para el cáncer y se están realizando diversos ensayos clínicos para tratar diferentes tipos de neoplasias: de mama, ovario, cabeza y cuello, pulmón, próstata, células renales, tumor cerebral, leucemia mieloide aguda, leucemia mieloide crónica, linfomas, melanoma, mieloma múltiple y neuroblastoma.
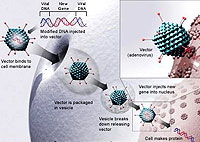
Existen diferentes estrategias aplicadas en las investigaciones realizadas en terapia génica del cáncer: aumentar la actividad antitumoral de células inmunes por medio de citoquinas (interleuquinas, factores de necrosis tumoral, factores estimulantes de colonias o interferones). Aumentar la inmunogenicidad del tumor introduciendo antígenos foráneos (“vacunas tumorales”). Introducir un gen “suicida” o de sensibilidad aumentada a determinados fármacos, aquí se transduce el gen de una enzima (timidina quinasa) que activa selectivamente un profármaco (aciclovir). Bloquear la expresión de oncogenes mediante terapia antisentido. Introducir genes supresores de tumores (p53). Eliminar las células tumorales mediante adenovirus oncolíticos. Transferencia de secuencias con efecto antiangiogénico, para inhibir la formación de vasos sanguíneos inducidos por el propio tumor, y finalmente, introducir genes de resistencia a fármacos para reducir la toxicidad de la quimioterapia, particularmente sobre la médula ósea.
Posibles efectos de la terapia
Actualmente sólo se realiza en ensayos clínicos que toman a menudo muchos años para finalizar. Después de que nuevas drogas o procedimientos son probados en laboratorios, las investigaciones se conducen con pacientes humanos bajo circunstancias estrictamente controladas. Tales ensayos duran dos a cuatro años y pasan generalmente por varias fases de la investigación. En el caso de los Estados Unidos, la Administración de Drogas y Alimentos (FDA) debe entonces aprobar la nueva terapia para el mercado, lo que puede tomar otros dos años más.
En el caso de los niños, la investigación más activa se ha realizado en desórdenes genéticos tales como la fibrosis quística. Otros ensayos implican a pequeños con inmunodeficiencias severas, tales como la deficiencia de adenosina desaminasa (ADA), una inmunodeficiencia que resulta de la carencia de la enzima adenosina desaminasa necesaria para la supervivencia de los linfocitos T en el sistema inmune y generalmente mortal durante los primeros meses de vida, y a aquellos con hipercolesterolemia familiar (niveles extremadamente altos de colesterol).
La terapia génica tiene riesgos y limitaciones. Los virus y otros agentes utilizados para entregar genes “buenos” pueden afectar a otras células diferentes. Si un gen se agrega al ADN, podría llegar al lugar incorrecto, lo que potencialmente podría causar cáncer u otro tipo de daño. Los genes pueden también estar sobre-expresados, generando la producción de una proteína que puede ser dañina. Otro riesgo es que un virus introducido en una persona pueda ser transmitido también al ambiente.
El futuro médico de la terapia génica
Para curar enfermedades genéticas los científicos deben determinar qué secuencias o sistema de genes causan cada enfermedad. El proyecto del genoma humano y otros esfuerzos internacionales recientemente han terminado el trabajo inicial de ordenar y trazar virtualmente los 25.000 a 35.000 genes. Esta investigación proporcionará nuevas estrategias para diagnosticar, tratar, curar y, posiblemente, prevenir enfermedades humanas.
Aunque esta información ayudará a los científicos a precisar las bases genéticas de muchas enfermedades, aún trascurrirán muchos años antes que las patologías puedan ser tratadas realmente con la terapia. El proyecto del genoma humano es un comienzo, ya que va a localizar los genes físicamente. El siguiente paso será determinar la función de estas secuencias. Una vez registrada esta información, se podrá aprovechar dicho conocimiento para proporcionar el tratamiento y/o las curaciones.
El potencial de la terapia revolucionará la medicina en el futuro, asó como sus expectativas para sanar y prevenir enfermedades durante la niñez están aumentando. Algún día podrá ser posible tratar a un niño antes del nacimiento para una enfermedad genética incluso antes de que aparezcan los síntomas. Los científicos esperan que la lectura final del genoma humano conduzca hacia la manera de curar una variada gama de enfermedades y que el éxito de los actuales ensayos clínicos cree nuevas oportunidades y desafíos. Por ahora, sin embargo, existe una situación de espera, de cauteloso optimismo.








