Nobel de Medicina para los padres del ratón de laboratorio
Los ratones llevan más de un siglo contribuyendo al avance de la medicina y a descubrimientos que han desempeñado un papel fundamental para tratar distintas enfermedades.
Este año, el Premio Nobel de Medicina y Fisiología reconoció la labor de los doctores Mario R. Capecchi, Martin J. Evans y Oliver Smithies que basaron sus investigaciones en células madre embrionarias de estos animales.
Sus descubrimientos llevaron a la creación de una tecnología inmensamente poderosa denominada gene targeting (recombinación homóloga), proceso por el cual un segmento de ADN puede sustituir a otro que tenga una secuencia similar. Esta técnica es utilizada por los investigadores para crear los ratones knock-out, en los cuales es posible anular la función de un gen específico, técnica que hoy se aplica prácticamente en todas las esferas de la biomedicina, desde la investigación básica hasta el desarrollo de nuevas terapias.
Estos genes knock-out han podido dilucidar las funciones de numerosos genes en el desarrollo embrionario, la fisiología de los adultos, el envejecimiento y ciertas enfermedades. Hasta la fecha, más de 10 mil genes de ratón (aproximadamente la mitad de los genes de los mamíferos) han sido eliminados. Por lo que, en un futuro próximo, los esfuerzos internacionales en curso permitirán tener ratones knock-out para todos los genes existentes.
Con la técnica gene targeting es posible producir casi cualquier tipo de modificación en el ADN del ratón, permitiendo a los científicos conocer las funciones de aquellos genes que tienen participación en la salud y en las enfermedades. El procedimiento ya ha producido más de 500 diferentes modelos de ratones para muchos trastornos humanos, incluyendo los cardiovasculares y enfermedades neurodegenerativas, la diabetes y el cáncer.
Modificación de genes por recombinación homóloga
La información sobre el desarrollo y función de nuestros cuerpos a través de la vida se lleva en el ADN. Nuestros genes se ubican en los cromosomas, los cuales se presentan en pares, uno heredado del padre y el otro de la madre. El intercambio de secuencias de ADN dentro de los pares de cromosomas aumenta la variación genética en la población y ocurre por un proceso llamado recombinación homóloga. Este mecanismo se ha conservado a través de la evolución y ya se había demostrado en bacterias hace más de 50 años por el premiado Nobel, el doctor Joshua Lederberg.
Mario Capecchi y Oliver Smithies tenían la percepción que la recombinación homóloga podría utilizarse para modificar específicamente los genes de células mamíferas y, por lo tanto, trabajaron constantemente hacia esa meta.
Por su parte, Capecchi demostró que la recombinación homóloga podría ocurrir entre el ADN introducido y los cromosomas de células mamíferas. Él demostró que los genes defectuosos se podrían reparar por recombinación homóloga a través del nuevo ADN. Smithies intentó inicialmente reparar secuencias génicas mutadas en células humanas. Pensaba que ciertas enfermedades de la sangre heredadas podrían ser tratadas corrigiendo las mutaciones que las causaban dentro de las células madre de médula. En estas tentativas Smithies descubrió que los genes endógenos podrían ser manejados con independencia de su actividad. Esto sugirió que todos los genes pueden ser modificados por recombinación homóloga
Células madre embrionarias: vehículos de líneas germinales de ratón
Los tipos celulares estudiados inicialmente por Capecchi y Smithies no se podían utilizar para crear genes dianas en animales. Esto requirió otro tipo de célula, una que podría dar lugar a células germinales. Sólo entonces las modificaciones del ADN podían ser heredadas.
Por otra parte, Martin Evans había trabajado con células de carcinoma embrional (CE de ratón), que aunque provenientes de tumores eran capaces de dar lugar a casi cualquier tipo de células. Tenía la visión para utilizar las células de CE como vehículo para introducir el material genético en la línea germinal de ratón.
Sus tentativas inicialmente fracasaron, porque las células embrionarias llevaban cromosomas anormales y, por lo tanto, no podían contribuir a la formación de la célula germinal. En busca de alternativas, Evans descubrió que los cultivos de células cromosómicamente normales se podrían habilitar directamente de embriones tempranos de ratón. Estas células ahora se llaman células madre embrionarias (CME).
El paso siguiente fue demostrar que las CME podrían contribuir a la línea germinal. Los embriones de un ratón fueron inyectados con CME de otra línea animal. Entonces, estos embriones mosaicos, es decir, integrados por células de ambas líneas, maduraron en las unidades madres sustitutas. Estos genes ahora serían heredados según las leyes de Mendel.
Evans comenzó a modificar genéticamente las CME y para su propósito eligió los retrovirusos, que integra su material genético en los cromosomas. Él demostró transferencia del ADN retroviral de las CME, a través de ratones mosaicos, en la línea germinal de ratón. También había utilizado las CME para generar ratones que llevaban el nuevo material genético.
Recombinación homóloga en células madre embrionarias
En 1986 se comenzaron a generar las primeras CME por recombinación. Capecchi y Smithies habían demostrado que la función génica se podría modificar por recombinación homóloga en células cultivadas, y Evans había contribuido con el vehículo necesario para la línea germinal de ratón, las CME. El paso siguiente era combinar los dos.
Para sus experimentos iniciales, tanto Smithies como Capecchi eligieron un gen (hprt) que era identificado fácilmente. Este gen está implicado en una rara enfermedad humana heredada (el síndrome de Lesch-Nyhan). Capecchi refinó las estrategias para llegar a los genes y desarrolló un nuevo método (la selección positivo-negativa, ver figura) que podría ser aplicado fácilmente.
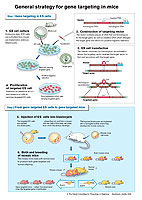
Los primeros estudios que reportaron que la recombinación homóloga en CME se estaba utilizando para generar ratones modificados se publicaron en 1989. Desde entonces, el número de artículos sobre estos animales knock-out ha crecido exponencialmente. La recombinación homóloga se ha convertido en una tecnología altamente versátil. Ahora es posible introducir mutaciones que se pueden activar en lugares, células u órganos específicos, durante el desarrollo o en animales adultos.
Es así como casi todos los aspectos de la fisiología mamífera pueden ser estudiados por gene targeting. Por lo tanto somos testigos de una explosiva cantidad de actividades de investigación que aplican la tecnología. La técnica molecular, es utilizada por muchos grupos de investigación y en amplios contextos que es imposible hacer un breve resumen de los resultados.
Este tipo de recombinación ha ayudado a entender la función de centenares de genes en el desarrollo fetal de los mamíferos. Los análisis de Capecchi han mostrado el rol de los genes implicados en el desarrollo de algunos órganos y en la estructura del cuerpo. Su trabajo ha mostrado una luz en las causas de varias malformaciones humanas.
Además, Evans aplicó la técnica para desarrollar modelos de ratón para estudiar enfermedades humanas. Él desarrolló varios para estudiar la fibrosis cística y ha utilizado estos modelos para trabajar los mecanismos de la enfermedad y para probar los efectos de la terapia génica.
Por su parte, Smithies también utilizó la recombinación homóloga para desarrollar los modelos de ratón en enfermedades hereditarias tales como la misma fibrosis y la talasemia. De igual manera desarrolló numerosos modelos de ratón para enfermedades humanas comunes como hipertensión y la aterosclerosis.
En resumen, la recombinación homóloga en ratones ha impregnado todos los campos de la biomedicina. Su impacto en la comprensión de la función de los genes y de sus beneficios para la humanidad continuará aumentando durante muchos años más.








