Reemplazo mitocondrial para herencias complejas
Este procedimiento refiere a un número de técnicas diseñadas para mover las mitocondrias de una célula a otra. Implica mover el citoplasma (incluyendo las mitocondrias) de un donante a un ovocito o embrión receptor. La transferencia se realiza típicamente añadiendo o intercambiando una pequeña proporción del volumen citoplasmático total, procedimiento que se ha propuesto como tratamiento para la infertilidad relacionada con la edad. Una forma más extrema de transferencia mitocondrial consiste en intercambiar la mayor cantidad posible de citoplasma. Esto se ha desarrollado para prevenir la transmisión de enfermedades de herencia mitocondrial. En la práctica, este proceso se logra eliminando los pronúcleos o los husos nucleares y colocándolos en un embrión u ovocito del donante. Sin embargo, lo que no cuenta con un respaldo es usar la transferencia mitocondrial para el tratamiento de la infertilidad: no hay pruebas objetivas de que sea eficaz para estos fines, por lo que es un motivo de preocupación el que este procedimiento se ponga a disposición en centros de fertilidad como un servicio clínico de rutina.
“Tratamiento” para la infertilidad
La legislación aprobada por la Cámara de los Lores en 2015 permitió la realización de la sustitución mitocondrial en el Reino Unido para la prevención de enfermedades mitocondriales graves. La regulación de este procedimiento fue delegada a la Autoridad de Fertilización y Embriología Humana, que otorgó su primera licencia a Newcastle upon Tyne Hospitals NHS Foundation Trust en 2017. La transferencia mitocondrial (o "bebés con tres padres", como se conocía en la prensa) es ahora un servicio del NHS encargado a nivel nacional en Inglaterra y Gales. En 2016 se informó de que una mujer dio a luz a un niño sano en México después de la transferencia del huso ovocitario para prevenir la herencia de un trastorno del ADN mitocondrial (ADNmt). Sin embargo, es motivo de especial preocupación que la técnica se haya puesto a disposición para el tratamiento de la infertilidad en muchos centros de fertilidad de todo el mundo (figura 1).
La transferencia del citoplasma de un donante al óvulo de una futura madre para tratar la infertilidad femenina no es algo nuevo, pero las pruebas que vinculan la disfunción mitocondrial relacionada con la edad con la infertilidad son en gran medida circunstanciales. No está claro que los defectos mitocondriales que se observan en los ovocitos obtenidos de mujeres mayores contribuyan a un riesgo de infertilidad o si son simplemente daños colaterales incidentales del proceso de envejecimiento. Además, no se sabe si la transferencia de mitocondrias por sí sola mejora la fertilidad. Los beneficios reportados, si son reales, podrían deberse a la transferencia de otros contenidos citoplasmáticos que inevitablemente acompañan a cualquier forma de reemplazo mitocondrial. Estas preocupaciones sustentan la reciente moratoria propuesta por la Sociedad Europea de Reproducción Humana y Embriología (ESHRE) sobre la base de la recomendación de un grupo de expertos, que llegó a la conclusión de que "la aplicación de la transferencia de huso como remedio para el tratamiento de la fertilidad sigue siendo vaga y no está demostrada".
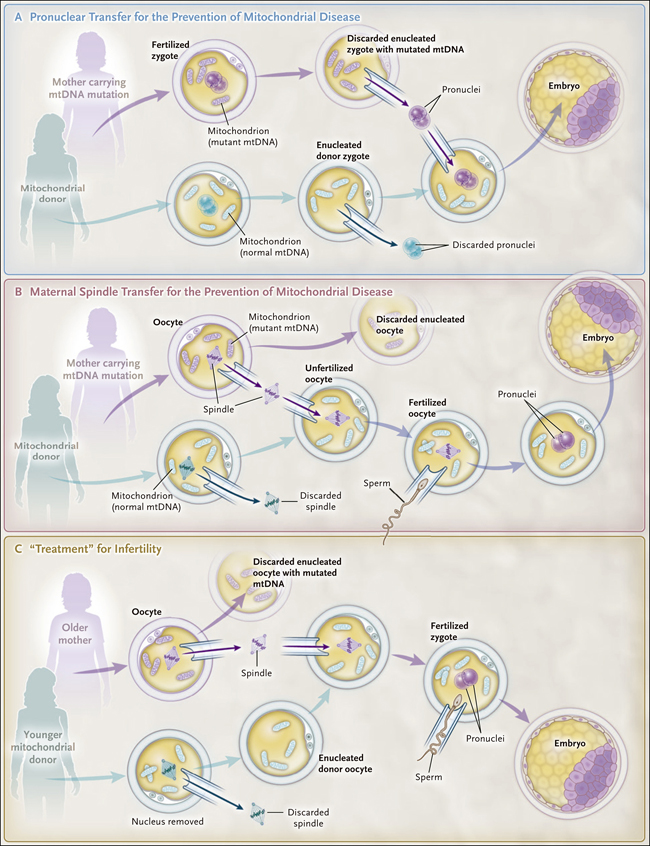
Figura 1. Principios de la transferencia mitocondrial.
A una potencial madre portadora de una mutación patogénica en su ADN mitocondrial (ADNmt) se le puede ofrecer la transferencia mitocondrial para reducir los riesgos de tener un hijo afectado por la enfermedad del ADNmt. Se han utilizado dos enfoques: la transferencia pronuclear (panel A) y la transferencia de huso (panel B), que permiten transferir el genoma nuclear a un cigoto u ovocito donante que contiene mitocondrias sin la mutación del ADNmt. Se ha ofrecido un enfoque similar a las mujeres con infertilidad con la esperanza de mejorar sus posibilidades de tener un hijo mediante la transferencia de mitocondrias a ovocitos no fecundados. Los primeros trabajos en este campo consistieron en la transferencia de citoplasma de un joven donante sano a ovocitos que se habían obtenido de una posible madre con infertilidad relacionada con la edad. Más recientemente, la transferencia de huso se ha utilizado para transferir el ADN nuclear del ovocito de una madre mayor a un ovocito enucleado de una donante antes de la fecundación in vitro (recuadro C).
El panel también hizo una declaración sobre la seguridad: "En la etapa actual, y hasta que esta tecnología haya demostrado ser efectiva y segura, la ESHRE desalienta fuertemente el uso de la donación mitocondrial para aliviar una condición de infertilidad". En la declaración de posición se señalaban las pruebas emergentes de una interacción entre las mitocondrias y el núcleo de la célula y se destacaba la posibilidad de que se produjeran secuelas. ¿Debería la preocupación por las secuelas informar nuestra posición sobre la transferencia mitocondrial en general, incluyendo su aplicación para prevenir las raras enfermedades hereditarias del ADNmt?
Antes de 2015, las limitadas pruebas de que la transferencia mitocondrial podría tener efectos adversos se basaban en un trabajo experimental en el que se estudiaron moscas de laboratorio y ratones endogámicos, en el que la falta de variabilidad genética crea un escenario sorprendentemente diferente del de la población humana endogámica. En los seres humanos, el ADNmt y el ADN nuclear parecen intercambiarse y mezclarse libremente sin detrimento. Sin embargo, tres laboratorios han visto una reversión imprevista al genotipo original de ADNmt en aproximadamente el 15% de los clones de células madre embrionarias derivadas de embriones humanos después de la transferencia mitocondrial. Estas reversiones han incluido una mutación patógena grave del ADNmt que causa el síndrome de Leigh, un trastorno neurológico que suele diagnosticarse en los primeros años de vida. El riesgo de reversión puede mitigarse con el uso de técnicas de diagnóstico convencionales tanto antes como después de la implantación, pero se desconocen las razones de la reversión. Actualmente existen pruebas de que las mitocondrias no son simplemente "paquetes de energía" celulares que pueden intercambiarse cuando se agotan. En los ratones, el intercambio del ADNmt entre cepas de laboratorio sanas, aunque endogámicas, ha dado lugar a un desajuste entre los genomas nuclear y mitocondrial, que no coexisten naturalmente en la misma cepa. Ese desajuste puede dar lugar a fenotipos cardiometabólicos que surgen en los ratones solo en la vejez.
Para el tratamiento de la infertilidad, no hay pruebas objetivas de que la transferencia mitocondrial sea eficaz, por lo que no debe utilizarse en la práctica clínica habitual. Y si hay incertidumbres sobre los efectos secundarios, ¿un ensayo clínico sería éticamente aceptable? Como suele ocurrir en medicina, los nuevos tratamientos se prueban primero en enfermedades más graves. ¿Podría ser el caso de prueba en los trastornos mitocondriales? A diferencia de la transferencia mitocondrial para el tratamiento de la infertilidad, el uso de la técnica para la prevención de los trastornos mitocondriales tiene un claro fundamento científico que respalda sus probables beneficios, pero ¿qué ocurre con los riesgos? El argumento que se suele presentar es que el riesgo de causar una enfermedad grave e incurable por ADNmt contrarresta los riesgos teóricos del tratamiento experimental. Sin embargo, prevenir la enfermedad mitocondrial no es lo mismo que tratar la enfermedad mitocondrial. Antes del inicio de la transferencia mitocondrial, no hay ningún niño. Los riesgos para el niño se generan al iniciar el tratamiento en sí, y el principal beneficio es dar a los futuros padres la opción de tener un hijo que comparta su genoma nuclear y no sea portador de una mutación patógena de ADNmt.
En el Reino Unido, la Autoridad de Fertilización y Embriología Humana ha estipulado sabiamente la necesidad de la supervisión a largo plazo de los resultados de salud de cualquier niño nacido como resultado de una transferencia mitocondrial. Debido a que los hipotéticos efectos secundarios podrían tardar años, si no décadas, en aparecer, la completa tranquilidad llevará algún tiempo. La razón por la que actualmente es aceptable ofrecer la transferencia mitocondrial en un contexto y no en el otro depende únicamente de la justificación científica del procedimiento y no del riesgo de efectos secundarios. En el caso de que se puedan establecer los beneficios basados en el mecanismo de la transferencia mitocondrial para el tratamiento de la infertilidad, sería razonable considerar un ensayo clínico de la transferencia mitocondrial para la infertilidad cuando todas las demás opciones hayan fracasado. Hasta que tal prueba se haya llevado a cabo, los centros de tratamiento que ofrecen hoy en día este procedimiento como un servicio clínico de rutina deberían dejar de hacerlo, y los médicos deberían advertir a los pacientes sobre la falta de beneficios comprobados.
Fuente bibliográfica
Mitochondrial Replacement in the Clinic
Patrick F. Chinnery, M.B., B.S., Ph.D., Sc.D.
Medical Research Council Mitochondrial Biology Unit, University of Cambridge, Cambridge, United Kingdom.
DOI: 10.1056/NEJMcibr2002015