La ruta desconocida del cáncer de mama
La metástasis es la principal causa de muertes relacionadas con el cáncer. Las lesiones metastásicas se desarrollan a partir de células cancerosas diseminadas (CCD) que pueden permanecer latentes. Se piensa que las células iniciadoras de estos procesos provienen de una subpoblación presente en tumores invasivos en desarrollo. Sin embargo, las CCD detectadas en pacientes antes de la manifestación de metástasis en cáncer de mama, contienen menos anomalías genéticas que los tumores primarios o que las mismas CCD de personas con metástasis. Estos hallazgos indican que la diseminación podría ocurrir durante las primeras etapas de la evolución del tumor. No obstante, se desconocen los mecanismos que podrían permitir una invasión completa. Estudios actuales muestran que, en lesiones tempranas en ratones y antes de que aparezcan masas tumorales primarias aparentes, hay una subpoblación de células cancerosas precoces invasoras que pueden propagarse hacia otros órganos. Estas investigaciones identifican un mecanismo para la diseminación temprana en la que factores proteicos alterados activan procesos similares a los ocurridos durante la ramificación ductal mamaria que genera CCD capaces de formar metástasis después de una fase de latencia.
Propagación celular temprana
El modelo convencional lineal para la progresión del cáncer indica que las células de un tumor en desarrollo obtienen gradualmente mutaciones genéticas, con células que acumulan variantes óptimas y eventualmente adquieren la capacidad de migrar e invadir otros tejidos. Esta teoría tiene una enorme influencia en las opiniones actuales sobre medicina personalizada, que recomiendan el secuenciamiento completo de tumores primarios para predecir y entender la resistencia tumoral a tratamientos. Esto representa un enfoque razonable sólo si las células cancerígenas diseminadas (CCD) que forman metástasis se derivan de las células que pueblan el tumor primario alrededor del tiempo de su detección. Sin embargo, parte de la evidencia actual indica que las células tumorales pueden dejar el sitio primario muy temprano durante su progresión y evolucionar independientemente en el sitio metastático. Dos recientes estudios dan a conocer los mecanismos de invasión temprana por primera vez (doi: 10.1038/nature20785; doi: 10.1038/nature20609). Sorprendentemente, ofrecen la primera evidencia de que esta CCD tempranas son más competentes para las metástasis que las células que salen del tumor en etapas posteriores.
Los primeros datos convincentes acerca del modelo de progresión lineal provinieron de estudios de cáncer de mama en humanos. El análisis genético de los tumores primarios de mama y de las CCD demostró que, en el momento de la detección, las CCD tuvieron menos alteraciones genéticas que las células primarias, lo que implica este tipo de células coloniza la médula ósea tempranamente durante la progresión de la enfermedad y evolucionan por separado. Esta teoría de la progresión paralela fue apoyada por la revelación de que el 20 - 30% de los pacientes clasificados con cáncer de mama "no invasivo" tienen CCD su médula ósea. Debido a que hasta el 8% de loscáncer no invasivos de mama recurren a sitios distantes, se asume que al menos algunos de estas CCD tienen potencial de iniciación de metástasis.
Modelos animales para el estudio del cáncer de mama ponen en duda la linealidad de la metástasis. En ratones, animales en los que el cáncer se induce por la sobreexpresión del gen Her2, las CCD pudieron ser detectables en la médula ósea a las cuatro semanas de edad, justo después de que la expresión Her2 comienza. Las alteraciones cancerosas en la glándula mamaria son detectables sólo por microscopía electrónica en esta etapa, y los tumores primarios palpables no se desarrollan sino hasta otras 14 semanas. A pesar de estos datos, aún no se han identificado los mecanismos moleculares que subyacen a la diseminación temprana de las células tumorales. En este sentido, los trabajos anteriormente citados volcaron sus análisis hacia los modelos de ratón con cáncer de mama inducidos por Her2.
Hosseini y colaboradores (doi: 10.1038/nature20785) analizaron la expresión génica en células epiteliales que recubren los conductos de la glándula mamaria, aislada antes de que los ratones alcanzaran 9 semanas de edad, momento en que los tumores todavía no son palpables. Su análisis sugiere que la progesterona impulsa la diseminación estos tumores tempranos microscópicos. Además, los autores demostraron que la hormona desencadena la secreción de las proteínas WNT4 y RANKL desde las células que expresan el receptor de progesterona (PGR), y que estas señales impregnan las células epiteliales que no expresan PGR, lo que favorece el potencial migratorio (figura 1a).
El efecto de la progesterona se reduce aparentemente a medida que progresa el desarrollo del tumor. Los autores encontraron que tanto la elevada densidad celular y el aumento de los niveles de la proteína HER2 impulsados por este cambio, inducen la expresión de moléculas de micro ARN que inhiben el gen codificante para el PGR. En efecto, ocurre un switch diseminación - poliferación cuando una región tumoral en desarrollo se llena lo suficiente.
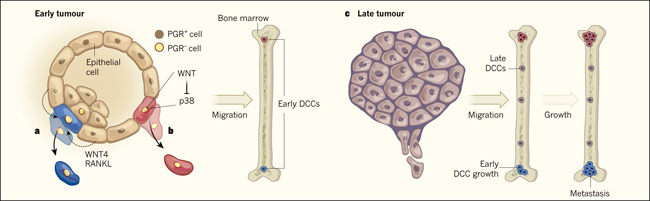
Figura 1: Mecanismos de diseminación temprana y metástasis en el cáncer de mama.
Dos investigaciones describen los mecanismos moleculares por los cuales las células epiteliales en las glándulas mamarias de ratones, impulsadas por la sobreexpresión del gen Her2, se diseminan desde la glándula hasta futuros sitios de metástasis, durante las etapas muy tempranas del desarrollo tumoral. a, Hosseini y sus colegas (doi: 10.1038/nature20785) evidenciaron que las proteínas WNT4 y RANKL se secretan a partir de células en tumores muy tempranos que expresan la proteína receptora de progesterona (PGR) (células PGR +). Las células cercanas que no expresan PGR (PGR-) se vuelven migratorias debido a la señalización de moléculas secretadas, y posteriormente invaden la médula ósea tempranamente como células cancerígenas diseminadas (CCD). b, Harper y colaboradores reportaron que los incrementos en la señalización WNT conducen a la inhibición de la proteína p38 y a la transición del estado de célula tumoral temprana hacia un estado de CCD invasivas. c, Las células de tumores tardíos también migran a la médula ósea. Ambos estudios ponen de manifiesto que las células que se diseminan tardíamente durante la progresión tumoral primaria forman metástasis en la médula ósea de una forma menos eficiente que las CCD, lo que implica que este tipo celular podría ser una fuente de las metástasis.
Harper y sus colegas (doi: 10.1038/nature20609) identificaron una población de células invasivas en tumores microscópicos caracterizada por la expresión de proteínas WNT impulsada por Her2. Las WNT contrarrestan la actividad de la enzima p38, que es típicamente expresada por CCD no proliferantes (latentes). La regulación negativa de p38 conduce a una reducción en la glicoproteína de adhesión celular E-cadherina y a la regulación positiva de varios otros genes implicados en la transición epitelio mesémquima, un cambio en el estado celular que facilita la invasión de células del tejido mamario en el torrente sanguíneo y, finalmente, en otros tejidos como en el caso de las CCD tempranas (figura 1b). La inhibición de p38 aumenta significativamente el número de células tumorales circulantes, así como el de CCD tanto en el pulmón como en la médula ósea, confirmando el papel de esta proteína en la diseminación.
Los autores encontraron que las CCD recuperan algunas de sus características epiteliales cuando alcanzan el pulmón y la médula ósea. De todos modos, no está claro si la señalización de p38 asociada a latencia se restaura cuando las células ingresan a esos sitios. Tampoco se sabe si estas primeras CCD son menos sensibles a las señales inductoras de quiescencia de sus nuevos microambientes en comparación a las células que dejan el tumor primario en las últimas etapas.
Ambas investigaciones demostraron que las CCD tempranas son inferiores a las tardías en su capacidad para formar tumores primarios si se implantan en otra glándula mamaria. Sin embargo, las CDD tempranas son sustancialmente más competentes para la metástasis al realizarlo más rápido y más prolíficamente que sus contrapartes (figura 1c).
Los mecanismos moleculares que impulsan la diseminación de lesiones mamarias tempranas que han sido identificados en estos estudios podrían no ser aplicables a todos los subtipos de cáncer de mama o a otros cánceres. No obstante, los resultados proveen un marco general para estudiar la causalidad entre las CCD tempranas y la metástasis, en particular en el caso de tipos de cáncer en los que la diseminación tumoral temprana es un fenómeno documentado, tales como cánceres de piel y del páncreas.
Fuente bibliográfica
Metastasis: Pathways of parallel progression
Cyrus M. Ghajar & Mina J. Bissell
Fred Hutchinson Cancer Research Center, Seattle, Washington 98109, USA.
doi:10.1038/nature21104
Temas Relacionados